
Anhydridegenskaper, hur de bildas och applikationer
De anhydrider De är kemiska föreningar som härrör från föreningen av två molekyler genom frisättning av vatten. Således kunde det ses som en uttorkning av de ursprungliga substanserna; även om det inte är exakt sant.
I organisk och oorganisk kemi nämns dem, och i båda grenarna skiljer sig deras förståelse i märkbar grad. Till exempel, i oorganisk kemi anses basiska och syraoxider vara anhydrider av deras hydroxider respektive syror, eftersom de förstnämnda reagerar med vatten för att bilda de senare..
Här kan förväxling uppstå mellan termerna 'vattenfri' och 'anhydrid'. I allmänhet avser vattenfri en förening till vilken den har torkats ut utan förändringar i dess kemiska natur (det finns ingen reaktion); medan det med en anhydrid sker en kemisk förändring, reflekterad i molekylstrukturen.
Om hydroxiderna och syrorna jämförs med motsvarande oxider (eller anhydrider), kommer det att ses att det fanns en reaktion. Å andra sidan kan vissa oxider eller salter hydratiseras, förlora vatten och förbli samma föreningar; men utan vatten, det vill säga vattenfritt.
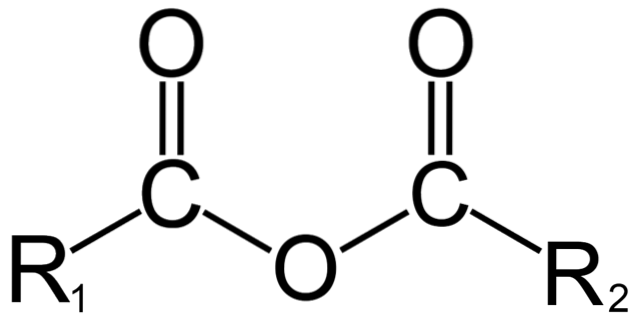
I organisk kemi, å andra sidan, vad som menas med anhydrid är den ursprungliga definitionen. Till exempel är en av de mest kända anhydriderna de som härrör från karboxylsyror (toppbild). Dessa består av föreningen av två acylgrupper (-RCO) genom en syreatom.
I sin allmänna struktur anges R1 för en acylgrupp och Rtvå för den andra acylgruppen. Eftersom R1 och Rtvå de är olika, de kommer från olika karboxylsyror och det är då en asymmetrisk syraanhydrid. När båda substituenterna R (oavsett om de är aromatiska) är desamma, talar vi i så fall om en symmetrisk syraanhydrid.
När två karboxylsyror binder till att bilda anhydriden kan vatten bildas eller inte, liksom andra föreningar. Allt beror på strukturen hos dessa syror.
Artikelindex
- 1 Egenskaper hos anhydrider
- 1.1 Kemiska reaktioner
- 2 Hur bildas anhydrider?
- 2.1 Cykliska anhydrider
- 3 Nomenklatur
- 4 applikationer
- 4.1 Organiska anhydrider
- 5 Exempel
- 5.1 Bärnstenssyraanhydrid
- 5.2 Glutarsyraanhydrid
- 6 Referenser
Egenskaper hos anhydrider
Anhydridernas egenskaper beror på vilka du refererar till. Nästan alla har gemensamt att de reagerar med vatten. Men för de så kallade basiska anhydriderna i oorganiska är faktiskt flera av dem till och med olösliga i vatten (MgO), så detta uttalande kommer att fokusera på anhydriderna av karboxylsyror.
Smält- och kokpunkter faller på molekylstrukturen och intermolekylära interaktioner för (RCO)tvåEller, detta är den allmänna kemiska formeln för dessa organiska föreningar.
Om molekylmassan av (RCO)tvåEller så är den låg, förmodligen en färglös vätska vid rumstemperatur och tryck. Till exempel ättiksyraanhydrid (eller etansyraanhydrid), (CH3CO)tvåEller, det är en vätska och den av största industriella betydelse, dess produktion är mycket stor..
Reaktionen mellan ättiksyraanhydrid och vatten representeras av följande kemiska ekvation:
(CH3CO)tvåO + HtvåO => 2CH3COOH
Observera att när vattenmolekylen tillsätts, frigörs två molekyler ättiksyra. Den omvända reaktionen kan dock inte inträffa för ättiksyra:
2CH3COOH => (CH3CO)tvåO + HtvåO (förekommer inte)
Det är nödvändigt att tillgripa en annan syntetisk väg. Dikarboxylsyror, å andra sidan, kan göra det genom uppvärmning; men det kommer att förklaras i nästa avsnitt.
Kemiska reaktioner
Hydrolys
En av de enklaste reaktionerna hos anhydrider är deras hydrolys, som just har visats för ättiksyraanhydrid. Förutom detta exempel finns det svavelsyraanhydrid:
HtvåStvåELLER7 + HtvåELLER <=> 2HtvåSW4
Här har du en oorganisk syraanhydrid. Observera att för HtvåStvåELLER7 (kallas även svavelsyra), reaktionen är reversibel, så uppvärmning HtvåSW4 koncentrat ger upphov till bildandet av dess anhydrid. Om det å andra sidan är en utspädd lösning av HtvåSW4, SO släpps3, svavelsyraanhydrid.
Förestring
Syraanhydrider reagerar med alkoholer, med pyridin däremellan, för att ge en ester och en karboxylsyra. Tänk till exempel på reaktionen mellan ättiksyraanhydrid och etanol:
(CH3CO)tvåO + CH3CHtvåOH => CH3COtvåCHtvåCH3 + CH3COOH
Således bildas esternetyletanoat, CH3COtvåCHtvåCH3, och etansyra (ättiksyra).
Praktiskt taget, vad som händer är substitutionen av väte i hydroxylgruppen, med en acylgrupp:
R1-OH => R1-OCORtvå
I fallet med (CH3CO)tvåEller dess acylgrupp är -COCH3. Därför sägs OH-gruppen genomgå acylering. Acylering och förestring är emellertid inte utbytbara begrepp; acylering kan ske direkt på en aromatisk ring, känd som Friedel-Crafts-acylering.
Således förestras alkoholer i närvaro av syraanhydrider genom acylering.
Å andra sidan reagerar endast en av de två acylgrupperna med alkoholen, den andra stannar kvar med väte och bildar en karboxylsyra; det för fallet med (CH3CO)tvåEller är etansyra.
Amidation
Syraanhydrider reagerar med ammoniak eller aminer (primära och sekundära) för att ge upphov till amider. Reaktionen liknar den förestring som just beskrivits, men ROH ersätts med en amin; till exempel en sekundär amin, RtvåNH.
Återigen, reaktionen mellan (CH3CO)tvåO och dietylamin, EttvåNH:
(CH3CO)tvåO + 2EttvåNH => CH3CONEttvå + CH3KUTTRA- +NHtvåEttvå
Och dietylacetamid, CH3CONEttvå, och ett karboxylerat salt av ammonium, CH3KUTTRA- +NHtvåEttvå.
Även om ekvationen kan verka lite svår att förstå, titta bara på hur -COCH-gruppen3 ersätta H för en EttvåNH för att bilda amiden:
EttvåNH => EttvåNCOCH3
Snarare än amidering är reaktionen fortfarande acylering. Allt sammanfattas i det ordet; den här gången genomgår aminen acylering och inte alkoholen.
Hur bildas anhydrider?
Oorganiska anhydrider bildas genom att reagera elementet med syre. Således, om elementet är metalliskt, bildas en metalloxid eller basisk anhydrid; och om den är icke-metallisk bildas en icke-metallisk oxid eller syraanhydrid.
För organiska anhydrider är reaktionen annorlunda. Två karboxylsyror kan inte förenas direkt för att frigöra vatten och bilda syraanhydrid; deltagande av en förening som ännu inte har nämnts är nödvändig: acylklorid, RCOCl.
Karboxylsyran reagerar med acylkloriden och producerar respektive anhydrid och väteklorid:
R1COCl + RtvåCOOH => (R1CO) ELLER (CORtvå) + HCl
CH3COCl + CH3COOH => (CH3CO)tvåO + HCl
A CH3 kommer från acetylgruppen, CH3CO-, och den andra finns redan i ättiksyra. Valet av en specifik acylklorid, såväl som karboxylsyran, kan leda till syntes av en symmetrisk eller asymmetrisk syraanhydrid.
Cykliska anhydrider
Till skillnad från andra karboxylsyror som kräver en acylklorid, kan dikarboxylsyror kondensera till motsvarande anhydrid. För detta är det nödvändigt att värma upp dem för att främja frisättningen av HtvåO. Exempelvis visas bildandet av ftalsyraanhydrid från ftalsyra.

Observera hur den femkantiga ringen är fullbordad och syret som förenar båda C = O-grupperna är en del av den; detta är en cyklisk anhydrid. På samma sätt kan det inses att ftalanhydrid är en symmetrisk anhydrid, eftersom båda R1 som Rtvå är identiska: en aromatisk ring.
Inte alla dikarboxylsyror har förmåga att bilda sin anhydrid, eftersom när deras COOH-grupper är åtskilda, tvingas de att slutföra större och större ringar. Den största ringen som kan bildas är en sexkantig, större än att reaktionen inte äger rum.
Nomenklatur
Hur heter anhydrider? Bortsett från de oorganiska, som är relevanta för oxidfrågor, beror namnen på de organiska anhydriderna som hittills förklarats på identiteten på R1 och Rtvå; det vill säga av dess acylgrupper.
Om de två R är desamma ersätter du helt enkelt ordet 'syra' med 'anhydrid' i respektive namn på karboxylsyran. Och om tvärtom de två R är olika, namnges de i alfabetisk ordning. För att veta vad man ska kalla det måste du först se om det är en symmetrisk eller asymmetrisk syraanhydrid.
CH3CO)tvåO är symmetrisk, eftersom R1= Rtvå = CH3. Den härstammar från ättiksyra eller etansyra, så namnet är enligt den tidigare förklaringen: ättiksyra eller etansyraanhydrid. Detsamma händer med den just nämnda ftalanhydriden.
Antag att vi har följande anhydrid:
CH3CO (O) COCHtvåCHtvåCHtvåCHtvåCHtvåCH3
Acetylgruppen till vänster kommer från ättiksyra och den till höger kommer från heptansyra. För att namnge denna anhydrid måste du namnge dess R-grupper i alfabetisk ordning. Så namnet är: heptanoic ättiksyraanhydrid.
Applikationer
Oorganiska anhydrider har oändliga tillämpningar, från syntes och beredning av material, keramik, katalysatorer, cement, elektroder, gödselmedel, etc., till som en beläggning av jordskorpan med dess tusentals järn- och aluminiummineraler och koldioxid utandad av levande organismer.
De representerar startkällan, den punkt där många föreningar som används i oorganiska synteser härleds. En av de viktigaste anhydriderna är koldioxid, COtvå. Det är, tillsammans med vatten, viktigt för fotosyntes. Och på industriell nivå, SO3 Det är väsentligt eftersom den svarande svavelsyra erhålls från den.
Kanske är anhydriden med flest applikationer och för att ha (medan det finns liv) en från fosforsyra: adenosintrifosfat, bättre känt som ATP, närvarande i DNA och metabolismens "energivaluta"..
Organiska anhydrider
Syraanhydrider reagerar genom acylering, antingen till en alkohol, bildar en ester, en amin, vilket ger upphov till en amid eller en aromatisk ring.
Det finns miljontals av var och en av dessa föreningar och hundratusentals karboxylsyraalternativ för att göra en anhydrid; därför växer de syntetiska möjligheterna dramatiskt.
Således är en av huvudapplikationerna att införliva en acylgrupp i en förening, som ersätter en av atomerna eller grupperna med dess struktur..
Varje separat anhydrid har sina egna applikationer, men i allmänhet reagerar de alla på samma sätt. Av denna anledning används dessa typer av föreningar för att modifiera polymera strukturer, vilket skapar nya polymerer; dvs sampolymerer, hartser, beläggningar etc..
Till exempel används ättiksyraanhydrid för att acetylera alla OH-grupper i cellulosa (lägre bild). Med detta ersätts varje H i OH med en acetylgrupp, COCH3.
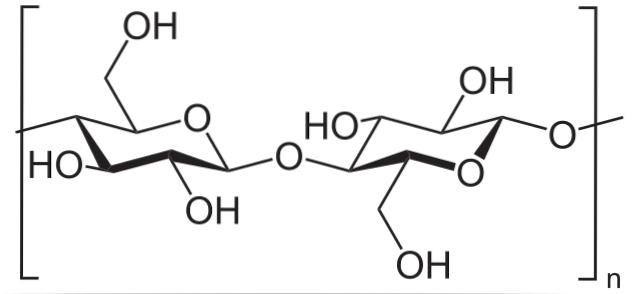
På detta sätt erhålles cellulosaacetatpolymeren. Samma reaktion kan beskrivas med andra polymera strukturer med NH-gruppertvå, också mottagliga för acylering.
Dessa acyleringsreaktioner är också användbara för syntes av läkemedel, såsom aspirin (syra acetylsalicylsyra).
Exempel
Några andra exempel på organiska anhydrider visas vara färdiga. Även om inget nämns av dem kan syreatomer ersättas med svavel, vilket ger svavel eller till och med fosforanhydrider..
-C6H5CO (O) COC6H5: bensoesyraanhydrid. Grupp C6H5 representerar en bensenring. Dess hydrolys ger två bensoesyror.
-HCO (O) COH: myrsyraanhydrid. Dess hydrolys ger två myrsyror.
- C6H5CO (O) COCHtvåCH3: bensoesyra propansyraanhydrid. Dess hydrolys producerar bensoesyra och propansyra.
-C6HelvaCO (O) COC6Helva: cyklohexankarboxylsyraanhydrid. Till skillnad från aromatiska ringar är dessa mättade utan dubbelbindningar.
-CH3CHtvåCHtvåCO (O) COCHtvåCH3: propansyra butansyraanhydrid.
Bärnstenssyraanhydrid

Här har du en annan cyklisk, härledd från bärnstenssyra, en dikarboxylsyra. Observera hur de tre syreatomerna avslöjar den kemiska naturen hos denna typ av förening.
Maleinsyraanhydrid liknar mycket bärnstenssyraanhydrid, med skillnaden att det finns en dubbelbindning mellan kol som bildar basen av pentagonen..
Glutarsyraanhydrid
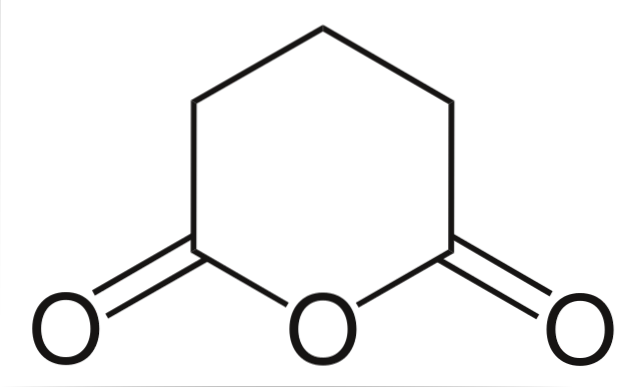
Och slutligen visas glutarsyraanhydrid. Detta skiljer sig strukturellt från alla andra genom att bestå av en sexkantig ring. Återigen sticker de tre syreatomerna ut i strukturen.
Andra anhydrider, mer komplexa, kan alltid bevisas av de tre syreatomerna mycket nära varandra.
Referenser
- Redaktörerna för Encyclopaedia Britannica. (2019). Anhydrid. Enclyclopaedia Britannica. Återställd från: britannica.com
- Helmenstine, Anne Marie, Ph.D. (8 januari 2019). Syraanhydriddefinition i kemi. Återställd från: thoughtco.com
- Kemi LibreTexts. (s.f.). Anhydrider. Återställd från: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th utgåva.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Organisk syraanhydrid. Återställd från: en.wikipedia.org

Ingen har kommenterat den här artikeln än.