
Enkel destillationsprocess och exempel
De enkel destillation är ett förfarande där ångorna som produceras av en vätska tas direkt till en kondensor, inom vilken ångornas temperatur sjunker och deras kondens uppstår.
Den används för att separera en flyktig komponent från de icke-flyktiga komponenterna som finns i en vätska. Det används också för separering av två vätskor som finns i en lösning med mycket olika kokpunkter..
Enkel destillation är inte en effektiv metod för separering av två flyktiga vätskor som finns i en lösning. När temperaturen på den ökar genom tillförsel av värme ökar också den kinetiska energin hos molekylerna, vilket gör att de kan övervinna sammanhållningskraften mellan dem..
Flyktiga vätskor börjar koka när deras ångtryck är lika med det yttre tryck som utövas på lösningen. Båda vätskorna bidrar till att ångan bildas, den mer flyktiga vätskan är större; det vill säga den med den lägsta kokpunkten.
Därför utgör den mer flyktiga vätskan det mesta av destillatet som bildas. Processen upprepas tills önskad renhet eller högsta möjliga koncentration uppnås..
Artikelindex
- 1 Enkel destillationsprocess
- 1.1 Utrustning
- 1.2 Kondensator
- 1.3 Uppvärmning
- 2 Exempel
- 2.1 Destillation av vatten och alkohol
- 2.2 Separation av flytande och fast ämne
- 2.3 Alkohol och glycerin
- 3 Referenser
Enkel destillationsprocess
I enkel destillation ökar temperaturen i en lösning tills den kokar. I det ögonblicket sker övergången mellan flytande till gasformiga tillstånd. Detta observeras när en konstant bubbla börjar i lösningen.
Team
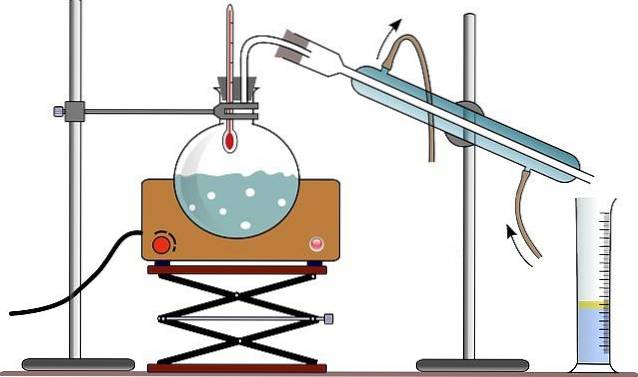
Utrustningen för enkel destillation består vanligtvis av en brännare eller en värmefilt (se bild); en rund eldfast glasflaska med en mald glasmunstycke för att möjliggöra kopplingen; och vissa glaspärlor (vissa använder en träpinne) för att minska storleken på de bildade bubblorna.
Glaspärlorna fungerar som bubbelbildande kärnor, som låter vätskan koka långsamt och undviker överhettning vilket resulterar i bildandet av ett slags jättebubblor. kan även utvisa en massa vätska ur destillationskolven.
Fäst vid kolvens mynning är en eldfast glasadapter med tre munningar som är gjorda av slipat glas. En hals är fäst vid destillationskolven, en andra hals är fäst vid kondensorn och den tredje halsen stängs med hjälp av en gummipropp..
I bilden saknar fästet denna adapter; och istället placeras termometern och en direkt anslutning till kondensorn genom samma gummipropp.
Kondensor
Kondensorn är en enhet som är utformad för att uppfylla den funktion som namnet indikerar: att kondensera ångan som rör sig genom den. Genom sin övre mun är den kopplad till adaptern, och genom dess nedre mun är den ansluten till en ballong där destillationsprodukterna samlas..
När det gäller bilden använder de (även om det inte alltid är korrekt) en graderad cylinder för att mäta den destillerade volymen på en gång.
Vattnet som cirkulerar genom kondensorns yttermantel, tränger in i det genom dess nedre del och går ut genom den övre delen. Detta säkerställer att kondensortemperaturen är tillräckligt låg för att tillåta kondensation av ångorna som produceras i destillationskolven..
Alla delar som utgör destillationsapparaten fixeras med klämmor anslutna till ett metallstöd.
En volym av lösningen som ska destilleras placeras i den runda kolven med lämplig kapacitet.
Korrekta anslutningar görs med grafit eller fett för att säkerställa effektiv tätning och uppvärmningen av lösningen börjar. Samtidigt börjar vattnet genom kondensorn.
Uppvärmning
När destillationskolven upphettas observeras en temperaturökning på termometern tills en punkt uppnås där temperaturen förblir konstant. Detta förblir så även om uppvärmningen fortsätter; såvida inte all flyktig vätska har avdunstat helt.
Förklaringen till detta beteende är att kokpunkten för komponenten med den lägsta kokpunkten för vätskeblandningen har uppnåtts, där dess ångtryck är lika med det yttre trycket (760 mm Hg).
Vid denna tidpunkt förbrukas all värmeenergi i övergången från vätsketillståndet till det gasformiga tillståndet som involverar utgången av vätskans intermolekylära sammanhållningskraft. Därför översätts inte värmetillförseln till en ökning av temperaturen..
Destillationens flytande produkt samlas i korrekt märkta kolvar, vars volymer beror på den volym som ursprungligen placerades i destillationskolven..
Exempel
Destillation av vatten och alkohol
Du har en 50% alkohol i vattenlösning. Att veta att alkoholens kokpunkt är 78,4 ° C och vattenens kokpunkt är ungefär 100 ° C, kan då en ren alkohol erhållas med ett enkelt destillationssteg? Svaret är nej.
Genom att värma alkohol-vattenblandningen uppnås kokpunkten för den mest flyktiga vätskan initialt; i detta fall alkohol. Ångan som bildas kommer att ha en högre andel av alkoholen, men det kommer också att finnas en hög närvaro av vatten i ångan, eftersom kokpunkterna är lika..
Vätskan som samlas upp från destillationen och kondensationen har en alkoholprocent som är större än 50%. Om denna vätska utsätts för successiva destillationer kan en koncentrerad alkohollösning uppnås; men inte rent, eftersom ångorna fortsätter att dra vatten till en viss komposition och bilda det som kallas en azeotrop
Den flytande produkten av jäsning av sockerarter har en alkoholprocent på 10%. Denna koncentration som kan bringas till 50%, som i fallet med whisky, genom enkel destillation.
Separation av flytande och fast ämne
En lösning av ett salt i vatten består av en vätska som kan förångas och en icke-flyktig förening med hög kokpunkt: salt..
Genom att destillera lösningen kan rent vatten erhållas i kondensvätskan. Under tiden kommer salterna att sätta sig längst ner i destillationskolven.
Alkohol och glycerin
Det finns en blandning av etylalkohol med en kokpunkt på 78,4 ° C och glycerin med en kokpunkt på 260 ° C. När den utsätts för enkel destillation kommer den ånga som bildas att ha en mycket hög alkoholprocent, nära 100%..
Därför kommer en destillerad vätska att erhållas med en procentandel alkohol, liknande den för ånga. Detta händer eftersom vätskans kokpunkter är väldigt olika.
Referenser
- Claude Yoder. (2019). Destillering. Wired Chemistry. Återställd från: wiredchemist.com
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Dragani, Rachelle. (17 maj 2018). Tre exempel på enkla destillationsblandningar. Sciencing. Återställd från: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (02 januari 2019). Vad är destillation? Kemidefinition. Återställd från: thoughtco.com
- Dr Welder. (s.f.). Enkel destillation. Återställd från: dartmouth.edu
- University of Barcelona. (s.f.). Destillering. Återställd från: ub.edu



Ingen har kommenterat den här artikeln än.