
Endotermiska reaktionsegenskaper, ekvationer och exempel

A endoterm reaktion Det är ett som ska ske måste absorbera energi, i form av värme eller strålning, från omgivningen. Generellt, men inte alltid, kan de kännas igen av ett temperaturfall i sin omgivning; eller tvärtom behöver de en värmekälla, som den som erhålls genom en brinnande eld.
Absorptionen av energi eller värme är det som alla endotermiska reaktioner har gemensamt; deras natur, liksom de involverade omvandlingarna, är mycket olika. Hur mycket värme ska de absorbera? Svaret beror på dess termodynamik: temperaturen vid vilken reaktionen sker spontant.

Till exempel är en av de mest emblematiska endotermiska reaktionerna tillståndsförändringen från is till flytande vatten. Is måste absorbera värme tills dess temperatur når cirka 0 ° C; vid den temperaturen blir dess smältning spontan, och isen kommer att absorberas tills den har smält helt.
I heta utrymmen, till exempel vid stranden, är temperaturen högre och därför absorberar isen värmen snabbare; det vill säga det smälter snabbare. Smältningen av glaciärer är ett exempel på en oönskad endoterm reaktion.
Varför händer det på det här sättet? Varför kan is inte se ut som ett hett fast ämne? Svaret ligger i den genomsnittliga kinetiska energin för vattenmolekylerna i båda tillstånden och hur de interagerar med varandra genom sina vätebindningar..
I flytande vatten har dess molekyler större rörelsefrihet än i is, där de vibrerar stillastående i dess kristaller. För att röra sig måste molekyler absorbera energi på ett sådant sätt att deras vibrationer bryter de starka riktade vätebindningarna i isen..
Av denna anledning absorberar is värme för att smälta. För att "het is" skulle existera måste vätebindningar vara onormalt starka för att smälta vid en temperatur som är väl över 0 ° C..
Artikelindex
- 1 Egenskaper för en endoterm reaktion
- 1.1 Ah> 0
- 1.2 De svalnar omgivningen
- 2 ekvationer
- 3 Exempel på vanliga endotermiska reaktioner
- 3.1 Avdunstning av torris
- 3.2 Bakning av bröd eller matlagning
- 3.3 Sola
- 3.4 Reaktion av atmosfärisk kväve- och ozonbildning
- 3.5 Elektrolys av vatten
- 3.6 Fotosyntes
- 3.7 Lösningar av vissa salter
- 3.8 Termiska sönderdelningar
- 3.9 Ammoniumklorid i vatten
- 3.10 Natriumtriosulfat
- 3.11 Bilmotorer
- 3.12 Kokande vätskor
- 3.13 Tillaga ett ägg
- 3.14 Matlagning
- 3.15 Värma mat i mikrovågsugnen
- 3.16 Glasformning
- 3.17 Konsumtion av ett ljus
- 3.18 Rengöring av varmvatten
- 3.19 Värmesterilisering av mat och andra föremål
- 3.20 Bekämpa infektioner med feber
- 3.21 Avdunstning av vatten
- 4 Referenser
Kännetecken för en endoterm reaktion
Tillståndsförändringen är inte korrekt en kemisk reaktion; samma sak händer dock: produkten (flytande vatten) har högre energi än reaktanten (isen). Detta är huvudegenskapen för en endoterm reaktion eller process: produkterna är mer energiska än reaktanterna.
Även om detta är sant betyder det inte att produkter nödvändigtvis måste vara instabila. Om det är så är den endotermiska reaktionen inte längre spontan under alla temperatur- eller tryckförhållanden..
Tänk på följande kemiska ekvation:
A + Q => B
Där Q representerar värme, vanligtvis uttryckt i enheterna joule (J) eller kalorier (cal). Eftersom A absorberar värme Q för att omvandlas till B, sägs det att det är en endoterm reaktion. Således har B mer energi än A och måste absorbera tillräckligt med energi för att uppnå sin transformation.
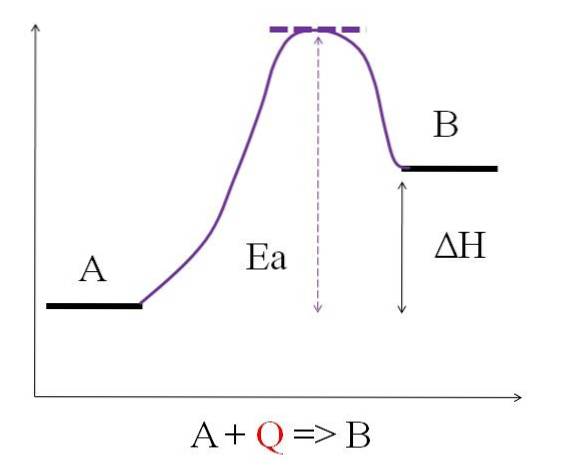
Som framgår av diagrammet ovan har A mindre energi än B. Mängden värme Q som absorberas av A är sådan att den övervinner aktiveringsenergin (energin som behövs för att nå den lila toppen med det prickade taket). Skillnaden i energi mellan A och B är känd som reaktionens entalpi, Ah.
Ah> 0
Alla endotermiska reaktioner har ovanstående diagram gemensamt, eftersom produkterna är mer energiska än reaktanterna. Därför är energidifferensen mellan dem, ΔH, alltid positiv (HProdukt-HReagens > 0). Eftersom detta är sant måste det finnas en absorption av värme eller energi från omgivningen för att tillgodose detta energibehov..
Och hur tolkas sådana uttryck? I en kemisk reaktion bryts alltid bindningar för att skapa nya. För att bryta dem är absorptionen av energi nödvändig. det vill säga det är ett endotermiskt steg. Under tiden innebär bildandet av bindningarna stabilitet, så det är ett exotermt steg..
När de bildade bindningarna inte ger stabilitet som är jämförbar med den mängd energi som krävs för att bryta de gamla bindningarna, är det en endoterm reaktion. Därför behövs ytterligare energi för att främja brytningen av de mest stabila bindningarna i reaktanterna..
Å andra sidan inträffar det motsatta i exoterma reaktioner: värme frigörs och Ah är < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
De svalnar omgivningen
Även om det inte gäller alla endotermiska reaktioner, orsakar flera av dem en minskning av temperaturen i omgivningen. Detta beror på att den absorberade värmen kommer någonstans. Följaktligen, om omvandlingen av A och B utfördes inuti en behållare, skulle den kylas.
Ju mer endoterm reaktionen är, desto kallare blir behållaren och dess omgivning. I själva verket kan vissa reaktioner till och med bilda ett tunt isskikt, som om de hade kommit ut ur ett kylskåp..
Det finns dock reaktioner av denna typ som inte svalnar omgivningen. Varför? Eftersom den omgivande värmen är otillräcklig; det vill säga det ger inte nödvändigt Q (J, cal) som är skrivet i kemiska ekvationer. Därför är det här när brand eller ultraviolett strålning kommer in..
Lite förvirring kan uppstå mellan de två scenarierna. Å ena sidan är värmen från omgivningen tillräcklig för att reaktionen ska gå spontant och kylning observeras; och å andra sidan behövs mer värme och en effektiv uppvärmningsmetod används. I båda fallen händer samma sak: energi absorberas.
Ekvationer
Vilka är de relevanta ekvationerna i en endoterm reaktion? Som redan förklarats måste Ah vara positivt. För att beräkna det beaktas först följande kemiska ekvation:
aA + bB => cC + dD
Där A och B är reaktanterna, och C och D är produkterna. De små bokstäverna (a, b, c och d) är de stökiometriska koefficienterna. För att beräkna ΔH för denna generiska reaktion tillämpas följande matematiska uttryck:
AhProdukter- AhReagenser = Ahrxn
Du kan fortsätta direkt eller göra beräkningarna separat. För ΔHProdukter följande summa måste beräknas:
c AHFC + d AHFD
Där ΔHF är entalpi av bildning av varje substans som är involverad i reaktionen. Enligt konvention har substanser i deras mest stabila former ΔHF= 0. Till exempel molekyler av Otvå och Htvå, eller en solid metall, har AHF= 0.
Samma beräkning görs nu för reaktanterna, AHReagenser:
a AhFA + b AHFB
Men eftersom ekvationen säger att ΔHReagenser måste subtraheras från ΔHProdukter, måste ovanstående summa multipliceras med -1. Så du har:
c AHFC + d AHFD - (a AHFA + b AHFB)
Om resultatet av denna beräkning är ett positivt tal är det en endoterm reaktion. Och om det testar negativt är det en exoterm reaktion.
Exempel på vanliga endotermiska reaktioner
Avdunstning av torris

Den som någonsin har sett de vita rökarna från en glassvagn har bevittnat ett av de vanligaste exemplen på en endoterm "reaktion".
Utöver vissa glassar har dessa ångor som avges från vita fasta ämnen, kallade torris, också varit en del av scenarierna för att skapa en dimmaeffekt. Denna torris är inget annat än fast koldioxid, som när den absorberar temperaturen och innan det yttre trycket börjar sublimera.
Ett experiment för en barnpublik skulle vara att fylla och försegla en påse med torris. Efter ett tag kommer det så småningom att blåsa upp på grund av COtvå gasformigt, vilket genererar arbete eller pressar påsens inre väggar mot atmosfärstryck.
Baka bröd eller laga mat

Bakning av bröd är ett exempel på en kemisk reaktion, eftersom det nu sker kemiska förändringar på grund av värme. Den som har känt doften av nybakade bröd vet att en endoterm reaktion sker.
Degen och alla dess ingredienser behöver värmen från ugnen för att genomföra alla omvandlingar, nödvändiga för att bli bröd och uppvisa dess typiska egenskaper..
Förutom bröd är köket fullt av exempel på endotermiska reaktioner. Den som lagar mat hanterar dem dagligen. Tillaga pasta, mjuka kärnorna, värma majskärnorna, laga ägg, krydda kött, baka en kaka, göra te, värma upp smörgåsar; var och en av dessa aktiviteter är endotermiska reaktioner.
Sola

Så enkelt och vanligt som de kan verka faller solbad som tas av vissa reptiler, såsom sköldpaddor och krokodiler, i kategorin endoterma reaktioner. Sköldpaddor absorberar värme från solen för att reglera deras kroppstemperatur.
Utan solen behåller de värmen från vattnet för att hålla sig varma; som hamnar i kylningen av vattnet i dina dammar eller akvarier.
Reaktion av atmosfärisk kväve- och ozonbildning

Luft består huvudsakligen av kväve och syre. Under elektriska stormar frigörs sådan energi att den kan bryta de starka bindningarna som håller kväveatomerna samman i N-molekylen.två:
Ntvå + ELLERtvå + Q => 2NO
Å andra sidan kan syre absorbera ultraviolett strålning för att bli ozon; allotrop av syre som är mycket fördelaktigt i stratosfären, men skadligt för livet på marknivå. Reaktionen är:
3Otvå + v => 2O3
Där v betyder ultraviolett strålning. Mekanismen bakom den enkla ekvationen är mycket komplex.
Elektrolys av vatten
Elektrolys använder elektrisk energi för att separera en molekyl i dess bildande element eller molekyler. Till exempel vid elektrolys av vatten genereras två gaser: väte och syre, var och en i olika elektroder:
2HtvåO => 2Htvå + ELLERtvå
Dessutom kan natriumklorid genomgå samma reaktion:
2NaCl => 2Na + Cltvå
I en elektrod ser du bildandet av metalliskt natrium och i den andra grönaktiga klorbubblor.
Fotosyntes

Växter och träd behöver absorbera solljus som en energiförsörjning för att syntetisera sina biomaterial. För detta använder den CO som råvara.två och vatten, som genom en lång serie steg omvandlas till glukos och andra sockerarter. Dessutom bildas syre som frigörs från bladen.
Lösningar av vissa salter
Om natriumklorid löses upp i vatten kommer ingen märkbar förändring att ske i glasets eller behållarens yttre temperatur..
Vissa salter, såsom kalciumklorid, CaCltvå, höja vattentemperaturen som en produkt av den stora hydratiseringen av Ca-jonertvå+. Och andra salter, såsom ammoniumnitrat eller klorid, NH4INTE3 och NH4Cl, sänk temperaturen på vattnet och kyla omgivningen.
I klassrum görs hemexperiment vanligtvis genom att lösa upp några av dessa salter för att visa vad en endoterm reaktion är..
Temperaturfallet beror på hydreringen av NH-jonerna4+ det gynnas inte mot upplösningen av de kristallina arrangemangen av dess salter. Följaktligen absorberar salterna värme från vattnet så att jonerna kan lösas..
En annan kemisk reaktion som vanligtvis är mycket vanligt för att visa detta är följande:
Ba (OH)två8HtvåO + 2NH4INTE3 => Ba (NEJ3)två + 2NH3 +10HtvåELLER
Notera mängden vatten som bildas. Genom att blanda båda fasta ämnena, en vattenlösning av Ba (NO3)två, luktar ammoniak och med en temperaturfall så att den bokstavligen fryser behållarens yttre yta.
Termiska sönderdelningar
En av de vanligaste termiska nedbrytningarna är natriumbikarbonat, NaHCO3, att producera COtvå och vatten vid uppvärmning. Många fasta ämnen, inklusive karbonater, bryts ofta ner för att frigöra COtvå och motsvarande oxid. Nedbrytningen av kalciumkarbonat är till exempel enligt följande:
Tjuv3 + Q => CaO + COtvå
Detsamma händer med magnesium, strontium och bariumkarbonater.
Det är viktigt att notera att termisk nedbrytning skiljer sig från förbränning. I den första finns det ingen närvaro av antändning eller värme frigörs, medan i den andra finns det; det vill säga förbränning är en exoterm reaktion, även när den behöver en initial värmekälla för att äga rum eller inträffa spontant.
Ammoniumklorid i vatten
När en liten mängd ammoniumklorid (NH4Cl) löses i vatten i ett provrör blir röret kallare än tidigare. Under denna kemiska reaktion absorberas värme från miljön.
Natriumtriosulfat
När kristaller av natriumtiosulfat (NatvåStvåELLER3.5HtvåO), vanligtvis kallad hicka, löses upp i vatten, kylningseffekt uppstår.
Bilmotorer
Förbränning av bensin eller diesel i motorer i bilar, lastbilar, traktorer eller bussar producerar mekanisk energi som används i cirkulationen av dessa fordon.
Kokande vätskor
Genom att värma en vätska får den energi och går i gasform.
Koka ett ägg
När värme appliceras denatureras äggproteinerna och bildar den fasta struktur som vanligtvis intas..
Lagar mat
I allmänhet inträffar endotermiska reaktioner alltid när man lagar mat med värme för att ändra matens egenskaper.
Dessa reaktioner är orsaken till att maten blir mjukare, genererar smidiga massor, släpper bland annat komponenterna som de innehåller..
Värmer mat i mikrovågsugnen
Genom mikrovågsstrålning absorberar vattenmolekyler i mat energi, börjar vibrera och ökar temperaturen på maten.
Gjutning av glas
Upptaget av värme genom glaset gör dess fogar flexibla, vilket gör dess form lättare att ändra.
Konsumtion av ett ljus
Ljusvax smälter genom att absorbera värmen från lågan och ändra formen.
Rengöring av varmvatten
När du använder varmt vatten för att rengöra föremål som har fläckats med fett, som krukor eller kläder, blir fettet mer flytande och lättare att ta bort.
Värmesterilisering av mat och andra föremål
Vid uppvärmning av föremål eller mat ökar också mikroorganismerna de innehåller.
När mycket värme tillförs uppstår reaktioner i mikrobiella celler. Många av dessa reaktioner, såsom att bryta bindningar eller denaturering av proteiner, slutar döda mikroorganismerna.
Bekämpa infektioner med feber
När feber uppstår beror det på att kroppen producerar nödvändig värme för att döda bakterier och virus som orsakar infektioner och genererar sjukdomar..
Om värmen som genereras är mycket och febern är hög påverkas också kroppens celler och det finns risk för dödsfall.
Avdunstning av vatten
När vatten förångas och förvandlas till ånga beror det på värmen från omgivningen. När värmeenergin tas emot av varje vattenmolekyl ökar dess vibrationsenergi till den punkt där den kan röra sig fritt och skapa ånga..
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2018). Endotermisk process. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27 december 2018). Endotermiska reaktionsexempel. Återställd från: thoughtco.com
- Khan akademin. (2019). Endotermisk vs. exoterma reaktioner. Återställd från: khanacademy.org
- Serm Murmson. (2019). Vad händer på molekylär nivå under en endoterm reaktion? Hearst Seattle Media. Återställd från: education.seattlepi.com
- QuimiTube. (2013). Beräkning av reaktionens entalpi från bildningens entalpier. Återställd från: quimitube.com
- Quimicas.net (2018). Exempel på endoterm reaktion. Återhämtad från:
kemi.net.



Ingen har kommenterat den här artikeln än.