
Antimonhistoria, struktur, egenskaper, användningsområden och risker
De antimon Det är en glänsande silvermetalloid med en viss blåaktig nyans. Dess fasta karaktär kännetecknas också av att den är mycket spröd och flagnande. Det tillhör grupp 15 i det periodiska systemet, med kväve. Efter vismut (och moscovium) är det gruppens tyngsta del.
Det representeras av den kemiska symbolen Sb. I naturen finns den främst i stibit- och ullmannitmineralmalmer, vars kemiska formler är SbtvåS3 respektive NiSbS. Dess höga tendens att bilda sulfider istället för oxider beror på dess kemiskt mjuka.

Å andra sidan är antimon också fysiskt mjukt och har en hårdhet på 3 på Mohs-skalan. Den är stabil vid rumstemperatur och reagerar inte med syre i luften. Men när det värms upp i närvaro av syre bildar det antimontrioxid, SbtvåELLER3.
På samma sätt är den resistent mot verkan av svaga syror; men när det är varmt attackeras det av salpetersyra och saltsyror.
Antimon har många tillämpningar, bland annat används det i legeringar med bly och tenn, vid tillverkning av bilbatterier, lågfriktionsmaterial etc..
Denna metalloid har den sällsynta egenskapen att den ökar i volym när den stelnar, vilket gör att dess legeringar helt kan uppta det utrymme som används för att forma instrumentet som ska tillverkas..
Artikelindex
- 1 Historia av dess upptäckt
- 1.1 Före Kristus
- 1.2 Introduktion av termen
- 1.3 Erhålla
- 2 Struktur av antimon
- 2.1 Allotropi
- 3 fastigheter
- 3.1 Atomvikt
- 3,2 atomnummer
- 3.3 Elektronisk konfiguration
- 3.4 oxidationstillstånd
- 3.5 Fysisk beskrivning
- 3.6 Smältpunkt
- 3.7 Kokpunkt
- 3.8 Densitet
- 3.9 Fusionsvärme
- 3.10 Förångningsvärme
- 3.11 Molär värmekapacitet
- 3.12 Elektronegativitet
- 3.13 Atomradie
- 3.14 Hårdhet
- 3.15 Stabilitet
- 3.16 Isotoper
- 3.17 Elektrisk och värmeledningsförmåga
- 3.18 Kemisk reaktivitet
- 4 användningsområden
- 4.1 Legeringar
- 4.2 Brandskyddsmedel
- 4.3 Elektronikfält
- 4.4 Medicin och veterinär
- 4.5 Pigment och färger
- 4.6 Andra användningsområden
- 5 risker
- 6 Referenser
Historien om dess upptäckt
före Kristus
Det finns bevis för att antimensulfid sedan 3100 f.Kr. användes som kosmetik i Egypten. I Mesopotamia, det nuvarande Irak, hittades rester av en vas och en annan artefakt som antagligen går mellan 3000 och 2200 f.Kr., där antimon användes i dess utarbetande.
Introduktion av termen
Den romerska forskaren Plinius den äldre (23-79 e.Kr.) beskrev användningen av antimon, som han kallade stibius, vid utarbetandet av sju läkemedel i sin avhandling om naturhistoria. Alkemisten Abu Mussa Jahir Ibn Hayyan (721-815) krediteras införandet av termen antimon för att namnge elementet.
Han använde följande etymologi: "anti" som en synonym för negation, och "mono" för endast. Sedan ville han betona att antimon inte bara fanns i naturen. Det är redan känt att det är en del av sulfidmineraler, liksom många andra element.
Erhållande
Den grekiska naturisten Pedanius Diascorides antas ha erhållit rent antimon genom att värma antimonsulfid i en luftström. Den italienska metallurg Vannocio Biringucio, i boken De la Pirotecnia (1540), beskriver en metod för att isolera antimon.
Den tyska kemisten Andreas Libavius (1615), genom att använda en smält blandning av järn, antimensulfid, salt och kaliumtartrat, uppnådde produktionen av ett kristallint antimon.
Den första detaljerade rapporten om antimon gjordes 1707 av den franska kemisten Nicolas Lemery (1645-1715), i hans bok Avhandling om antimon.
Antimonstruktur
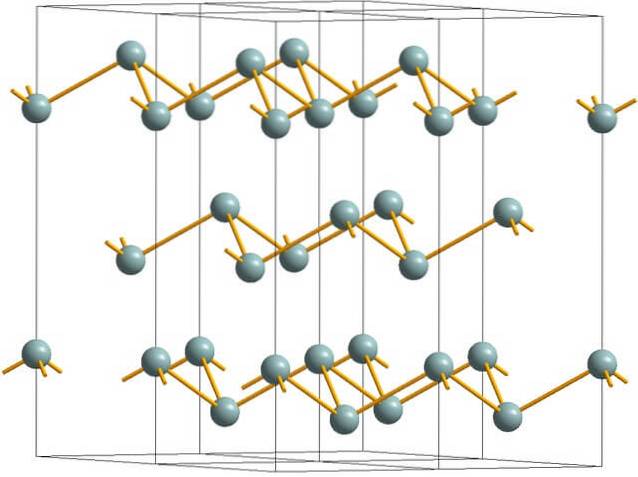
Den övre bilden visar den skrynkliga skiktade strukturen som antogs av arsenatomer. Emellertid antar gråaktigt antimon, bättre känt som metalliskt antimon, också denna struktur. Det sägs vara "skrynkligt" eftersom det finns Sb-atomer som stiger och faller från det plan som består av skiktet.
Dessa skikt, även om de är ansvariga för fotonerna som interagerar med den, lyser silverglänsande strålar och får antimon att passera som en metall, men sanningen är att de krafter som förenar dem är svaga; följaktligen kan de uppenbara metallfragmenten av Sb lätt mals och sprött eller flagnande.
Sb-atomerna i de skrynkliga skikten är inte heller tillräckligt nära för att gruppera sina atomorbitaler för att skapa ett band som möjliggör elektrisk ledning..
Om man ser en gråaktig sfär individuellt kan man se att den har tre Sb-Sb-bindningar. Från ett högre plan kunde Sb ses i mitten av en triangel, med tre Sb placerade vid dess hörn. Triangeln är dock inte plan och har två våningar eller våningar..
Den laterala reproduktionen av sådana trianglar och deras bindningar skapar skrynkliga lager, som ligger i linje för att bilda rombohedrala kristaller..
Allotropi
Den just beskrivna strukturen motsvarar gråaktigt antimon, det mest stabila av dess fyra allotroper. De andra tre allotroperna (svart, gul och explosiv) är metastabila; det vill säga de kan existera under mycket hårda förhållanden.
Det finns inte mycket information om deras strukturer. Det är emellertid känt att svart antimon är amorft, så dess struktur är rörig och invecklad..
Gult antimon är stabilt under -90 ° C, fungerar som ett icke-metalliskt grundämne och kan antas bestå av små agglomerat av Sb-typ4 (liknar de med fosfor); vid uppvärmning förvandlas den till den svarta allotropen.
Och när det gäller explosivt antimon består det av en gelatinös avsättning bildad på katoden under elektrolys av en vattenlösning av en antimonhalogenid..
Vid den minsta starka friktionen eller stöten släpper det mjuka fasta ämnet så mycket värme att det exploderar och stabiliseras när dess atomer samlas i den rombohedrala kristallstrukturen av gråaktigt antimon..
Egenskaper
Atomvikt
121,76 g / mol.
Atomnummer
51.
Elektronisk konfiguration
[Kr] 4d105stvå5 s3.
Oxidationstillstånd
-3, -2, -1, +1, +2, +3, +4, +5.
Fysisk beskrivning
Glänsande silver fast, sprött, med en fjällig yta, med en blåaktig nyans. Det kan också visas som ett svart pulver.
Smältpunkt
630,63 ºC.
Kokpunkt
1 635 ºC.
Densitet
-6,697 g / cm3 vid rumstemperatur.
-6,53 g / cm3 i flytande tillstånd, temperatur lika med eller högre än smältpunkten.
Fusionsvärme
19,79 kJ / mol.
Förångningsvärme
193,43 kJ / mol.
Molär värmekapacitet
25,23 J / mol.K
Elektronnegativitet
2.05 (Pauling-skala).
Atomradio
140.00.
Hårdhet
Det är ett mjukt element, med en hårdhet på 3 på Mohs-skalan och kan repas av glas.
Stabilitet
Den är stabil vid rumstemperatur och upplever inte oxidation. Det är också resistent mot syraattacker.
Isotoper
Den har två stabila isotoper: 121Sb och 123Sb. Dessutom finns det 35 radioaktiva isotoper. Den radioaktiva isotopen 125Sb är den med den längsta halveringstiden: 2,75 år. I allmänhet avger radioaktiva isotoper β-strålning+ och β-.
Elektrisk och värmeledningsförmåga
Antimon är en dålig ledare för värme och elektricitet.
Kemisk reaktivitet
Det kan inte förskjuta väte från utspädda syror. Bildar joniska komplex med organiska och oorganiska syror. Metalliskt antimon reagerar inte med luft utan omvandlas snabbt till oxid i fuktig luft..
Halogener och sulfider oxiderar lätt antimon om processen sker vid förhöjda temperaturer.
Applikationer
Legeringar
Antimon används i en legering med bly för att göra plattor för bilbatterier, vilket förbättrar plattornas motstånd samt laddningens egenskaper..
Legeringen med bly och tenn har använts för att förbättra svetsarnas egenskaper, liksom för spårkulor och patrondetonatorer. Den används också i legeringar för beläggning av elektriska kablar..
Antimon används i antifriktionslegeringar, vid tillverkning av tenn- och härdningslegeringar med låg tennhalt vid tillverkning av organ och andra musikinstrument..
Den har den egenskap, som delas med vatten, att den ökar i volym när den kondenserar; Därför fyller antimonet som finns i legeringarna med bly och tenn alla utrymmen i formarna, vilket förbättrar definitionen av strukturerna gjorda med nämnda legeringar..
Brandskyddsmedel
Antimontrioxid används för att framställa brandhämmande föreningar, alltid i kombination med halogenerade brandskyddsmedel, bromider och klorider..
Brandskyddsmedel kan reagera med syreatomer och OH-radikaler, vilket hämmar eld. Dessa flamskyddsmedel används i barnkläder, leksaker, flygplan och i bilbarnstolar.
De tillsätts också i polyesterhartser och i glasfiberkompositer för föremål som används som skydd för lättflygmotorer..
Antimonföreningar som används som brandskyddsmedel inkluderar: antimonoxiklorid, SbOCl; antimonpentoxid, SbO5; antimontriklorid, SbCl3; och antimontrioxid, SbO3.
Elektronik fält
Den används vid tillverkning av halvledare, dioder, mitt-infraröda detektorer och vid tillverkning av transitorer. Antimon med hög renhet, som används i halvledarteknik, erhålls genom att reducera antimonföreningar med väte.
Medicin och veterinär
Antimonföreningar har använts i medicin sedan antiken som emetika och antiprotozoer. Kaliumkaliumtartrat (tartaremetikum) användes som antischistosom under lång tid; används dessutom som ett slemlösande medel, diaforetiskt och emetiskt.
Antimonsalter har också använts vid konditionering av hud hos idisslare. såsom aniomalin och litiumantimontiomalat.
Meglumin antimoniate är ett läkemedel som används vid behandling av leishmaniasis i yttre foci hos husdjur. Även om de terapeutiska fördelarna var begränsade.
Pigment och färger
Antimonföreningar används vid tillverkning av färger och opacifier i emaljer. De används också i vermilion, gula och orange pigment, som är produkter av långsam oxidation av antimensulfider..
Några av dess organiska salter (tartrater) används i textilindustrin för att hjälpa till att binda vissa färgämnen.
Antimensulfid användes i forntida Egypten som ett kosmetiskt medel för att göra ögonen mörkare.
Andra användningsområden
Vissa antimonsalter används som beläggningsmedel för att avlägsna mikroskopiska bubblor som bildas på tv-skärmar. Antimonjoner interagerar med syre, vilket eliminerar dess tendens att bilda bubblor.
Antimon (III) sulfid används i huvudet på vissa säkerhetsmatcher. Antimensulfid används också för att stabilisera friktionskoefficienten för material som används i bilbromsbelägg..
Isotop 124Sb, tillsammans med beryllium, används som en neutronkälla, med ett energimedel på 24 keV. Dessutom används antimon som katalysator vid produktion av plast..
Risker
Det är ett sprött element så att förorenande damm från miljön kan produceras under hanteringen. Hos arbetstagare som utsätts för antimonstoft har dermatit, renit, inflammation i övre luftvägarna och konjunktivit observerats.
Pneumokonios, ibland i kombination med obstruktiva lungförändringar, har beskrivits efter långvarig exponering.
Antimontrioxid kan orsaka livshotande skador på hjärtfunktionen.
Hos personer som utsätts för detta element har förekomsten av övergående pustulär hudinfektioner observerats..
Kontinuerligt intag av låga doser av denna metall kan orsaka diarré, kräkningar och magsår. På samma sätt är den maximalt acceptabla koncentrationen i luft 0,5 mg / m3.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Manny. (11 mars 2009). Gult antimon och explosivt antimon. Återställd från: antimonyproperties.blogspot.com
- Prof. Ernst Cohen och J. C. Van Den Bosch. (1914). Antimonets allotropi. Proceedings Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimon. Återställd från: en.wikipedia.org
- Advameg, Inc. (2019). Antimon. Återställd från: chemistryexplained.com
- Sable Mc'Oneal. (15 september 2018). Kemi: egenskaper och tillämpning av Sb-Antimon. Återställd från: medium.com



Ingen har kommenterat den här artikeln än.