
Bensenhistoria, struktur, egenskaper, derivat, användningar
De bensen Det är en organisk förening som består av en av de enklaste aromatiska kolvätena av alla. Dess kemiska formel är C6H6, varav det är känt att förhållandet mellan kol och väte är lika med 1; det vill säga för varje kol finns ett väte bundet till det.
Även om dess fysiska utseende är som en färglös vätska, finns det naturligt i petroleum och petroleumprodukter. Dess lukt är mycket karakteristisk, eftersom den liknar en blandning av lim, bitumen och bensin; å andra sidan är det en flyktig och brandfarlig vätska.

Bilden ovan visar en behållare eller flaska med bensen, antagligen av icke-analytisk renhet. Om de avslöjas skulle bensenångorna omedelbart spridas i hela laboratoriet. Av denna anledning hanteras denna vätska, som vanligtvis används som ett enkelt lösningsmedel, inuti en dragskåp..
Att vara dess formel C6H6, kemister från 1800-talet föreslog många möjliga strukturer som skulle motsvara nämnda C / H-förhållande lika med 1. Inte bara detta utan även bensenmolekylen måste ha speciella bindningar på ett sådant sätt att dess ovanliga stabilitet mot additionsreaktioner kunde förklaras; typiskt för alkener och polyener.
Det var således deras länkar representerade en gåta för kemister på den tiden; tills fastigheten ringde aromatisitet. Innan man betraktar en hexacyklotrien (med tre C = C-bindningar) är bensen mycket mer än det, och det är ett annat av de många exemplen på synergi inom kemi.
I organisk kemi är bensen en klassisk symbol, den strukturella grunden för flera polyaromatiska föreningar. Ändlösa derivat erhålls från dess hexagon via aromatisk elektrofil substitution; en ring från vars kanter strukturen som definierar nya föreningar är vävd.
Faktum är att dess derivat beror på de stora industriella användningsområdena för vilka de behöver bensen som råvara. Från beredning av lim och textilfibrer till plast, gummi, pigment, droger och sprängämnen. Å andra sidan finns bensen naturligt i vulkaner, skogsbränder, bensin och i cigarettrök..
Artikelindex
- 1 Historia
- 1.1 Upptäckt och namn
- 1.2 Industriproduktion
- 1.3 Historiska strukturer
- 2 Struktur av bensen
- 2.1 Resonans
- 2.2 Kristaller
- 3 fastigheter
- 3.1 Molekylär massa
- 3.2 Fysiskt utseende
- 3.3 Kokpunkt
- 3.4 Smältpunkt
- 3.5 Flampunkt
- 3.6 Självantändningstemperatur
- 3.7 Densitet
- 3.8 Löslighet
- 3.9 Ångdensitet
- 3.10 Ångtryck
- 3.11 Förbränningsvärme
- 3.12 Förångningsvärme
- 3.13 ytspänning
- 3.14 Brytningsindex
- 4 Derivat
- 5 användningsområden
- 6 Nomenklatur
- 7 Toxicitet
- 8 Referenser
Berättelse
Upptäckt och namn
Dess upptäckt går tillbaka till 1825, vanligtvis tillskriven Michael Faraday, när han samlade och gjorde experiment med en återstående oljeprodukt av gasen som användes för belysning. Denna vätska innehöll ett C / H-förhållande nära 1, varför han kallade det 'förgasat väte'.
Kemist Auguste Laurent kallade det konstiga kolväten "feno", härstammande från det grekiska ordet "phaínein'vilket betyder ljus (eftersom det erhölls efter att gasen brände). Detta namn accepterades emellertid inte av det vetenskapliga samfundet och rådde bara som 'fenyl', för att hänvisa till den radikal som härrör från bensen.
Från bensingummi lyckades kemisten Eilhard Mitscherlich, nio år senare, producera samma förening; Därför fanns det en annan källa för samma kolväte, som han döpte som 'bensin'. De ansåg emellertid inte heller det lämpliga namnet, förutsatt att det var en alkaloid, som kinin..
Således ersatte de namnet "bensin" med "bensol". Men återigen fanns det motsägelser och avvikelser till följd av att termen "bensol" förvirrade kolväten för en alkohol. Det var då namnet "bensen" föddes, först användes i Frankrike och England..
Industriell produktion
Varken belysningsgas eller bensingummi var lämpliga källor för att generera bensen i stor skala. Charles Mansfield, som arbetade med August Wilhelm von Hofmann, lyckades 1845 att isolera bensen (tjugo år efter upptäckten) från koltjära, en biprodukt från koksproduktion..
Således började den industriella produktionen av bensen från koltjära. Tillgängligheten av bensen i stora mängder underlättade studien av dess kemiska egenskaper och gjorde det möjligt att relatera till andra föreningar med liknande reaktiviteter. August Wilhelm von Hofmann själv myntade ordet "aromatisk" för bensen och besläktade föreningar.
Historiska strukturer
August Kekulés dröm
Friedrich August Kekulé tillskrivs den sexkantiga och cykliska strukturen av bensen omkring år 1865, som härrör från en konstig dröm med Uroboros, ormen som biter sin egen svans genom att rita en cirkel. Således trodde han att bensen kunde betraktas som en sexkantig ring, och andra kemister föreslog möjliga strukturer, som visas nedan:

Några av de högre strukturerna kan stå för bensenens stabilitet.
Bok, ringar och prisma
Observera att den tredje strukturen inte ens är en ring utan ett triangulärt prisma, som föreslogs av Albert Ladenburg 1869; till vänster, en i form av en öppen bok, föreslagen av Sir James Dewar 1867; och till höger, en med alla väten riktade mot mitten av ringen, föreslagen av Henry Edward Armstrong 1887.
Den första strukturen, som föreslogs av Adolf Karl Ludwig Claus 1867, är också ganska märklig, eftersom C-C-länkar är korsade. Och den sista var Kekulés "serpentin" ring, drömde om 1865.
Vad var "vinnaren"? Den femte strukturen (från vänster till höger), föreslagen 1899 av Johannes Thiele.
I denna studie övervägdes resonanshybriden för första gången, som kombinerade de två Kekulé-strukturerna (vrid den första ringen till höger för att observera den) och förklarade utomordentligt avlokalisering av elektroner och därmed den tills dess ovanliga stabiliteten hos bensen.
Bensenens struktur
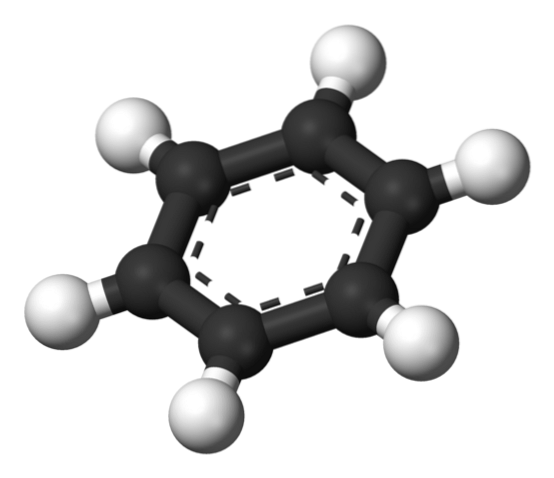
Ovan är den struktur som Thiele föreslår med hjälp av en modell av sfärer och stänger..
Bensenmolekylen är platt, med väteatomerna pekade utåt från sidorna av ringen. Alla kolatomer har sp-hybridiseringtvå, med en orbital sid tillgängliga för att skapa det aromatiska systemet där sex elektroner avlägsnas.
Dessa kol sptvå är mer elektronegativa än väten, och därför drar den förra elektroniska densiteten till den senare (Csp25--H5+). Följaktligen har mitten av ringen en högre koncentration av elektroner än dess sidor..
Mer exakt kan det aromatiska systemet representeras som ett elektroniskt moln eller en kudde expanderad på båda sidor om den sexkantiga ringen; och i mitten, vid sidorna eller kanterna, en elektronisk brist som består av väten med en positiv partiell laddning.
Tack vare denna fördelning av elektriska laddningar kan bensenmolekyler interagera med varandra genom dipol-dipolkrafter; H-atomer5+ lockas till doftcentret i en angränsande ring (detta visas nedan).
De aromatiska centren kan också staplas ovanpå varandra för att gynna induktionen av de momentana dipolerna..
Resonans

De två Kekulé-strukturerna visas längst upp på bilden och under dem resonanshybriden. Eftersom de två strukturerna uppträder om och om igen samtidigt representeras hybriden av en cirkel ritad i mitten (liknande den för en "sexkantig munk").
Hybridcirkeln är viktig eftersom den indikerar den aromatiska karaktären hos bensen (och den hos många andra föreningar). Dessutom påpekar han att länkarna inte är så långa som C-C, och inte heller så korta som C = C; men dess längd är mellan båda ytterligheterna. Således anses bensen inte vara en polyen.
Det ovan nämnda har demonstrerats genom att mäta längderna på C-C-bindningar (139 pm) av bensen, som är lite mer långsträckta än C-H-bindningarna (109 pm).
Kristaller
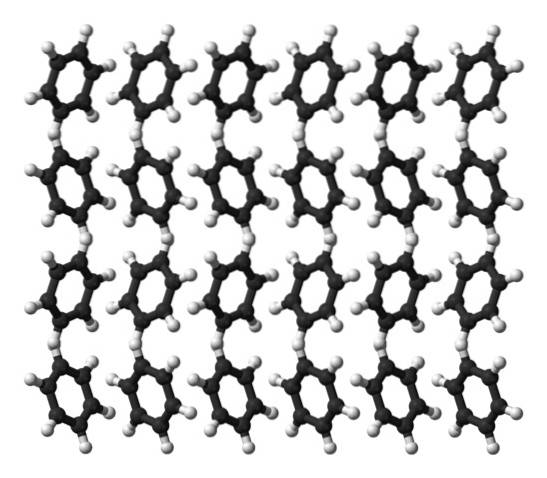
Bensen är en vätska vid rumstemperatur. Dess intermolekylära krafter innebär att den, trots att den inte har ett så uttalat dipolmoment, kan hålla ihop sina molekyler i en vätska som kokar vid 80 ° C. När temperaturen sjunker under 5 ° C börjar bensen att frysa: och därmed erhålls motsvarande kristaller..
Bensenringar kan anta definierade strukturella mönster i sin fasta form. Deras dipoler får dem att "luta" åt vänster eller höger och bilda rader som kan reproduceras av en ortorombisk enhetscell. Således är bensenkristaller ortorombiska.
Observera i den övre bilden att lutningen av ringarna gynnar samspelet mellan H5+ och aromatiska centra, nämnda i tidigare underavsnitt.
Egenskaper
Molekylär massa
78,114 g / mol.
Fysiskt utseende
Färglös vätska med en bensinliknande lukt.
Kokpunkt
80 ° C.
Smältpunkt
5.5ºC.
antändningspunkt
-11ºC (sluten kopp).
Självantändningstemperatur
497,78ºC.
Densitet
0,8765 g / ml vid 20 ° C.
Löslighet
En liter kokande vatten kan knappt lösa upp 3,94 g bensen. Dess icke-polära karaktär gör den praktiskt taget oblandbar med vatten. Det är emellertid blandbart med andra lösningsmedel, såsom etanol, etrar, aceton, oljor, kloroform, koltetraklorid, etc..
Ång-densitet
2.8 relativt luft (dvs. nästan tre gånger så tät).
Ångtryck
94,8 mm Hg vid 25 ° C.
Förbränningsvärme
-3267,6 kJ / mol (för flytande bensen).
Förångningsvärme
33,83 kJ / mol.
Ytspänning
28,22 mN / m vid 25 ° C.
Brytningsindex
1,5011 vid 20 ° C.
Derivat
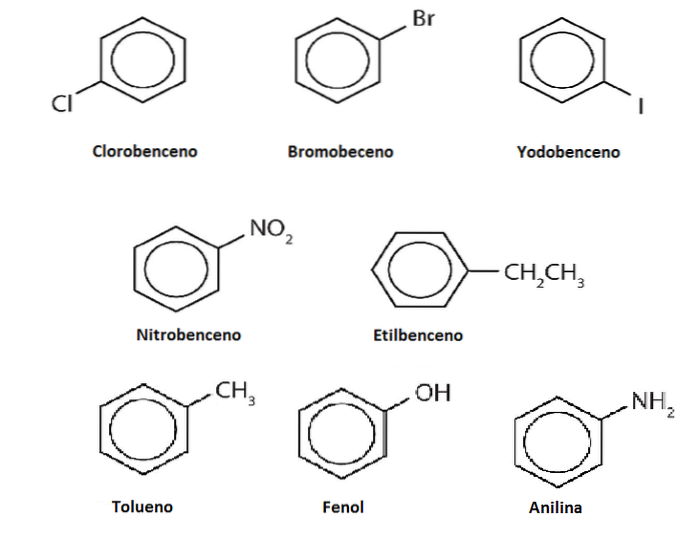
Väten av bensen kan ersättas med andra grupper eller atomer. Det kan finnas en eller flera substitutioner, vilket ökar substitutionsgraden tills ingen av de ursprungliga sex vätena finns kvar.
Antag till exempel bensen som Ph-H, där H är någon av dess sex väten. Kom ihåg att mitten av ringen har en högre elektrontäthet, det lockar elektrofiler, som attackerar ringen för att ersätta H i en reaktion som kallas elektrofil aromatisk substitution (SEAr).
Om detta H ersätts med en OH kommer vi att ha Ph-OH, fenol; ersätts av en CH3, Ph-CH3, toluen; om det är NHtvå, Ph-NHtvå, anilin; eller om det är CHtvåCH3, Ph-CHtvåCH3, etylbensen.
Derivaten kan vara samma eller mer toxiska än bensen, eller tvärtom kan de bli så komplexa att de har en önskvärd farmakologisk effekt..
Applikationer
Det är ett bra lösningsmedel för en mängd olika föreningar, närvarande till exempel i färger, lacker, lim och beläggningar.
Det kan också lösa upp oljor, fetter eller vaxer, varför det har använts som ett extraherande lösningsmedel för essenser. Den här egenskapen användes av Ludwig Roselius 1903 för koffeinfri kaffe, en operation som inte längre används på grund av bensens toxicitet. På samma sätt användes det tidigare för att avfetta metaller.
I ett av dess klassiska användningsområden fungerar det inte som ett lösningsmedel utan som ett tillsatsmedel: ökar oktantalet av bensin och ersätter bly för detta ändamål..
Derivat av bensen kan ha olika användningsområden; vissa fungerar som bekämpningsmedel, smörjmedel, rengöringsmedel, plast, sprängämnen, parfymer, färgämnen, lim, droger etc. Om en bensenring observeras i dess struktur är det troligt att dess syntes har börjat från bensen.
Bland dess viktigaste derivat är: kumen, xylen, anilin, fenol (för syntes av fenolhartser), bensoesyra (konserveringsmedel), cyklohexan (för syntes av nylon), nitrobensen, resorcinol och etylbensen.
Nomenklatur
Nomenklaturen för bensenderivat varierar beroende på graden av substitution, vilka substituentgrupperna är och deras relativa positioner. Således kan bensen genomgå mono, di, tri, tetra, etc., substitutioner
När de två grupperna är fästa vid intilliggande kol används beteckningen "ortho"; om det finns ett kol mellan att separera dem, 'meta'; och om kolen är i motsatta positioner, "para".
Bilderna nedan visar exempel på bensenderivat med deras respektive namn som styrs av IUPAC. De åtföljs också av vanliga eller traditionella namn.
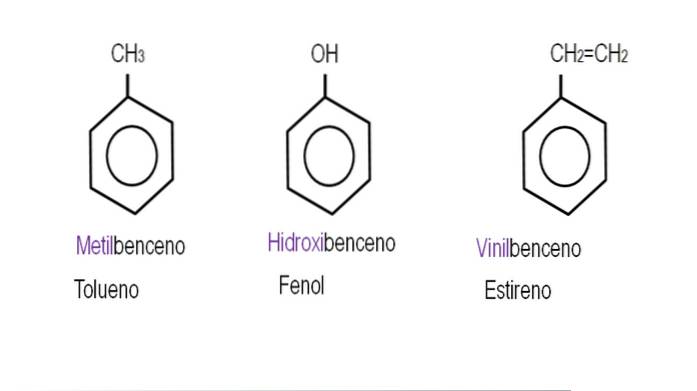
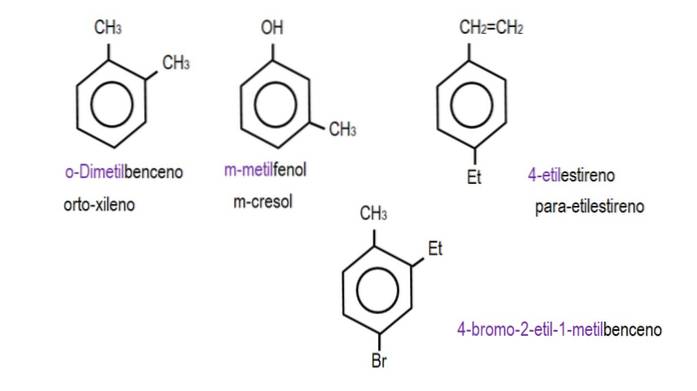
Observera att i trisubstituerad bensen är orto-, para- och metaindikatorerna inte längre användbara..
Giftighet
Bensen är en förening som måste hanteras med försiktighet. Med tanke på dess speciella lukt kan de omedelbara negativa effekterna vara kvävning, yrsel, huvudvärk, skakningar, sömnighet, illamående och till och med dödsfall (med hög exponering). Om det intas kan det, förutom det ovan nämnda, orsaka allvarliga magont och kramper..
Dessutom är de långsiktiga effekterna vid konstant exponering för denna vätska cancerframkallande; ökar chansen att individen kommer att drabbas av någon typ av cancer, särskilt blodcancer: leukemi.
I blodet kan det minska koncentrationen av röda blodkroppar, orsaka anemi, och också påverka benmärgen och levern, där det assimileras av kroppen för att generera ännu mer giftiga bensenderivat; till exempel hydroxikinon. Det ackumuleras också i njurarna, hjärtat, lungorna och hjärnan..
Referenser
- Morrison, R.T. och Boyd, R. N. (1987). Organisk kemi. (5: e upplagan). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organisk kemi. (6: e upplagan). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Nationellt centrum för bioteknikinformation. (2019). Bensen. PubChem-databas. CID = 241, Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Bensen. Återställd från: en.wikipedia.org
- Garcia Nissa. (2019). Vad är bensen? - Användning, struktur och formel. Studie. Återställd från: study.com
- Centers for Disease Control and Prevention. (04 april 2018). Fakta om bensen. Återställd från: emergency.cdc.gov
- Världshälsoorganisationen. (2010). Exponering för bensen: ett stort folkhälsoproblem. [PDF]. Återställd från: who.int
- Fernández Germán. (s.f.). Bensennomenklaturproblem. Organisk kemi. Återställd från: quimicaorganica.org

Ingen har kommenterat den här artikeln än.