
Borhistoria, egenskaper, struktur, användningsområden
De bor Det är ett icke-metalliskt element som leder grupp 13 i det periodiska systemet och representeras av den kemiska symbolen B. Dess atomnummer är 5 och det är det enda icke-metalliska elementet i sin grupp; även om vissa kemister anser att det är en metalloid.
Det verkar som ett svartbrunt pulver och finns i en andel av 10 ppm i förhållande till jordskorpan. Därför är det inte ett av de vanligaste elementen.

Det finns som en del av flera mineraler som borax eller natriumborat, detta är det vanligaste bormineralet. Det finns också kurnit, en annan form av natriumborat; kolemanit eller kalciumborat; och ulexit, natrium och kalciumborat.
Borates utvinns i USA, Tibet, Kina och Chile med en världsproduktion på cirka två miljoner ton per år.
Detta element har tretton isotoper, den mest förekommande varelsen elvaB, som utgör 80,1 viktprocent bor, och 10B, som utgör de återstående 19,9%.
Bor är ett viktigt spårämne för växter, som ingriper i syntesen av vissa vitala växtproteiner och bidrar till absorptionen av vatten. Hos däggdjur verkar det vara nödvändigt för benhälsan.
Även om bor upptäcktes 1808 av den engelska kemisten Sir Humphry Davy och de franska kemisterna Jacques Thérnard och Joseph Gay-Lussac, användes borax sedan början av vår tid i Kina vid tillverkning av emaljkeramik..
Bor och dess föreningar har många användningsområden och applikationer, allt från dess användning vid konservering av mat, speciellt margarin och fisk, till dess användning vid behandling av cancertumörer i hjärnan, urinblåsan, prostata och andra organ.
Bor är dåligt lösligt i vatten, men dess föreningar är det. Detta kan vara en mekanism för koncentration av bor, liksom en förgiftningskälla med elementet..
Artikelindex
- 1 Historia
- 1.1 Bakgrund
- 1.2 Upptäckt av element
- 1.3 Identifiering och isolering
- 2 fastigheter
- 2.1 Fysisk beskrivning
- 2.2 Molmassa
- 2.3 Smältpunkt
- 2.4 Kokpunkt
- 2.5 Densitet
- 2.6 Fusionsvärme
- 2.7 Förångningsvärme
- 2.8 Molär värmekapacitet
- 2.9 Joniseringsenergi
- 2.10 Elektronegativitet
- 2.11 Atomradie
- 2,12 atomvolym
- 2.13 Värmeledningsförmåga
- 2.14 Elektrisk resistivitet
- 2.15 Hårdhet
- 2.16 Reaktivitet
- 3 Borstens struktur och elektronkonfiguration
- 3.1 Länkar och strukturella enheter i bor
- 3,2 a-rombohedral bor
- 3,3 β-rombohedral bor
- 3.4 Bor-γ bergsalt
- 3.5 Kubik och amorf
- 3.6 Borophenes
- 3.7 Elektronisk konfiguration
- 4 Skaffa
- 5 användningsområden
- 5.1 Inom industrin
- 5.2 I medicin
- 5.3 Biologiska åtgärder
- 6 Risker och försiktighetsåtgärder
- 7 Referenser
Berättelse
Bakgrund
Sedan urminnes tider har människan använt borföreningar i olika aktiviteter. Borax, ett mineral som kallas tincal, användes i Kina år 300 e.Kr. vid tillverkning av emaljkeramik.
Den persiska alkemisten Rhazes (865-925) nämnde först borföreningar. Rhazes klassificerade mineralerna i sex klasser, varav en var boracios som innehöll bor.
Agricola, omkring 1600, rapporterade användningen av borax som ett flöde i metallurgin. 1777 kändes närvaron av borsyra i en varm källström nära Florens.
Element upptäckt
Humphry Davy observerade genom elektrolys av en boraxlösning ackumuleringen av en svart fällning på en av elektroderna. Han upphettade också boroxid (BtvåELLER3) med kalium, vilket ger ett svartbrunt pulver som var den kända formen av bor.
Gay-Lussac och Thénard reducerade borsyra vid höga temperaturer i närvaro av järn för att producera bor. De visade också den omvända processen, det vill säga där borsyra är en produkt av oxidation av bor.
Identifiering och isolering
Jöns Jakob Berzelius (1827) lyckades identifiera bor som ett nytt element. 1892 lyckades den franska kemisten Henri Moissan producera bor med 98% renhet. Även om det påpekas att bor producerades i ren form av den amerikanska kemisten Ezekiel Weintraub år 1909.
Egenskaper
Fysisk beskrivning
Kristallint fast eller amorft svartbrunt pulver.
Molmassa
10,821 g / mol.
Smältpunkt
2076 ºC.
Kokpunkt
3927 ºC.
Densitet
-Vätska: 2,08 g / cm3.
-Kristallint och amorft vid 20 ºC: 2,34 g / cm3.
Fusionsvärme
50,2 kJ / mol.
Förångningsvärme
508 kJ / mol.
Molär värmekapacitet
11,087 J / (mol K)
Joniseringsenergi
-Första nivå: 800,6 kJ / mol.
-Andra nivån: 2427 kJ / mol.
-Tredje nivån: 3 659,7 kJ / mol.
Elektronnegativitet
2.04 på Pauling-skalan.
Atomradio
90 pm (empirisk).
Atomvolym
4,16 cm3/ mol.
Värmeledningsförmåga
27,4 W / m.K
Elektrisk resistans
~ 106 Ω.m (vid 20 ° C).
Bor vid höga temperaturer är en bra elektrisk ledare, men vid rumstemperatur blir det nästan en isolator.
Hårdhet
~ 9,5 på Mohs-skalan.
Reaktivitet
Bor påverkas inte av saltsyra vid kokpunkten. Det omvandlas emellertid av het salpetersyra till borsyra (H3BO3). Bor beter sig kemiskt som en icke-metall.
Reagerar med alla halogener för att ge mycket reaktiva trihalider. Dessa har den allmänna formeln BX3, där X representerar halogen.
Den kombinerar med olika element för att få ursprung till borider. Några av dem är bland de hårdaste ämnena; till exempel bornitrid (BN). Bor kombineras med syre för att bilda bortrioxid.
Struktur och elektronkonfiguration av bor
Länkar och strukturella enheter i bor
Innan man tar upp strukturerna av bor (kristallin eller amorf) är det viktigt att komma ihåg hur dess atomer kan kopplas. B-B-bindningen är väsentligen kovalent; Inte bara det, utan för att boratomer naturligt uppvisar elektronisk brist, kommer de att försöka leverera det i sina obligationer på ett eller annat sätt..
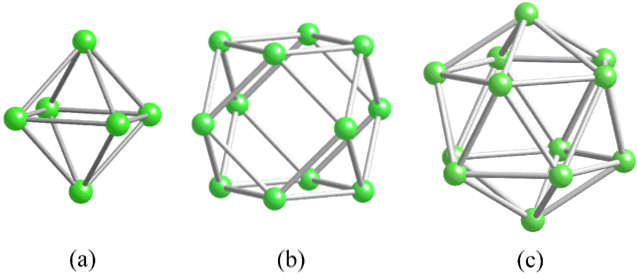
I bor observeras en speciell typ av kovalent bindning: den med tre centra och två elektroner, 3c2e. Här delar tre boratomer två elektroner och definierar en triangel, en av de många ansikten som finns i deras strukturella polyeder (övre bild).
Från vänster till höger har vi: oktaedron (a, B.6), kuboktaeder (b, B12), och isocashedronen (c, B12 också). Alla dessa enheter delar en egenskap: de är elektronfattiga. Därför tenderar de att länka kovalent med varandra; och resultatet är en fest med fantastiska länkar.
I varje triangel av dessa polyeder är 3c2e-bindningen närvarande. Annars kunde det inte förklaras hur bor, som endast kan bilda tre kovalenta bindningar enligt Valencia Bond Theory, kan ha upp till fem bindningar i dessa polyhedrala enheter..
Borstrukturer består sedan av ett arrangemang och upprepning av dessa enheter som slutligen definierar en kristall (eller ett amorft fast ämne).
Α-rombohedral bor
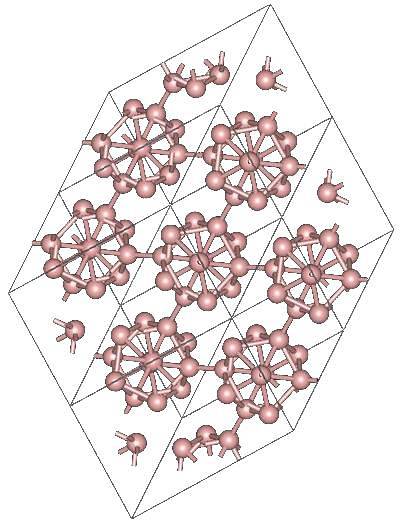
Det kan finnas andra polyhedrala borenheter, liksom en som består av endast två atomer, Btvå; en bor "linje" som måste vara bunden till andra atomer på grund av dess höga elektroniska brist.
Icosahedronen är överlägset den föredragna borenheten; den som passar dig bäst. I bilden ovan kan du till exempel se hur dessa B-enheter12 sammanflätas för att definiera den rombohedrala kristallen av Bor-a.
Om du ville isolera en av dessa icosahedra skulle det vara en komplicerad uppgift, eftersom dess elektroniska brist tvingar dem att definiera en kristall där var och en bidrar med de elektroner som de andra grannarna behöver..
Β-rombohedral bor
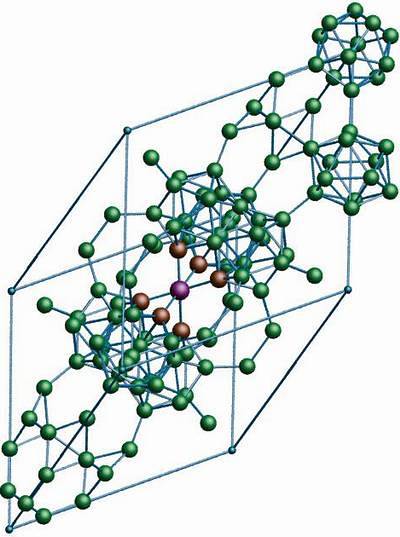
Allotropboret β-rombohedral har, som namnet redan indikerar, rombohedrala kristaller som bor-α; men det skiljer sig åt i sina strukturella enheter. Det ser ut som ett främmande fartyg gjord av boratomer.
Om du tittar noga kan icosahedral-enheterna ses på ett diskret och smält sätt (i mitten). Det finns också B-enheter10 och ensamma boratomer som fungerar som en bro för de nämnda enheterna. Av allt är detta den mest stabila borallotropen.
Bor-y bergsalt
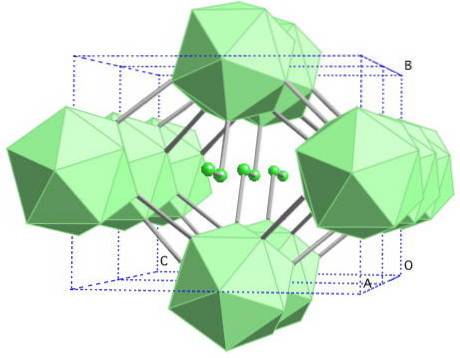
I denna borallotrop koordineras B-enheternatvå och B12. Btvå är så elektroniskt bristfällig att den faktiskt tar bort elektroner från B.12 och det finns därför en jonisk karaktär i denna fasta substans. Det vill säga, de är inte bara kovalent bundna utan det finns elektrostatisk attraktion av typ [Btvå-] [B12+].
Bor-y kristalliserar sig till en bergsaltstruktur, samma som för NaCl. Det erhålls genom att utsätta andra borallotroper för höga tryck (20 GPa) och temperaturer (1800 ° C) för att senare förbli stabila under normala förhållanden. Dess stabilitet konkurrerar faktiskt med den för β-rombohedral bor.
Kubisk och amorf
Andra borallotroper består av aggregat av B-atomer som om de var förenade av en metallbindning, eller som om de vore joniska kristaller; det vill säga det är en kubisk bor.
Dessutom, och inte mindre viktigt, är amorf bor, vars arrangemang av B-enheter12 det är slumpmässigt och rörigt. Framstår som ett glasigt fast eller fint pulver av matt brun och mörk färg.
Borophenes
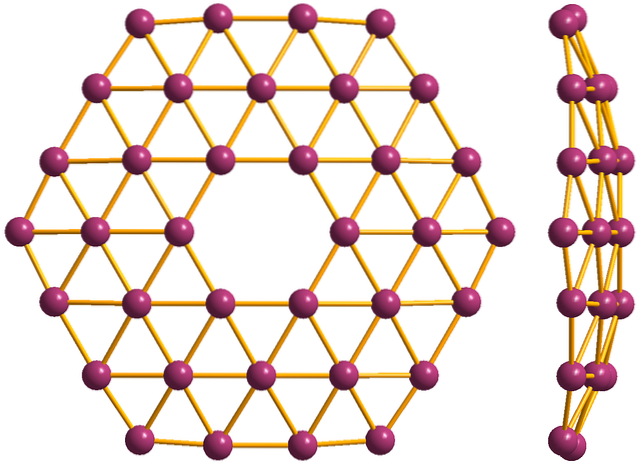
Och slutligen finns det den nyaste och mest bisarra allotropen av bor: borofener (toppbild). Den består av ett monolager av boratomer; extremt tunn och analog med grafen. Observera att den bevarar de berömda trianglarna, som är karakteristiska för den elektroniska bristen som dess atomer lider av.
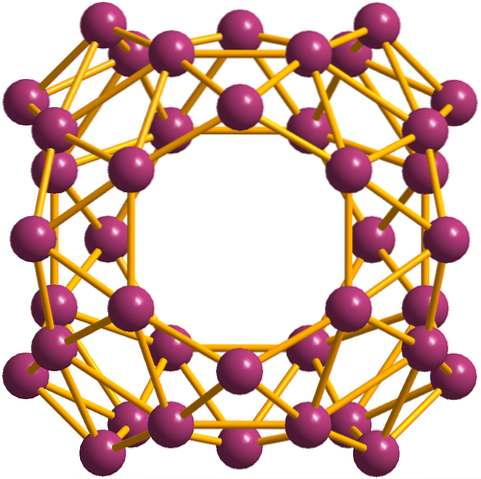
Förutom borofenerna, av vilka B36 är det enklaste och minsta, det finns också borkluster. Borosfären (bilden nedan) består av en kulliknande sfärisk bur med fyrtio boratomer, B40; men i stället för att ha släta kanter är de plötsliga och ojämna:
Elektronisk konfiguration
Elektronkonfigurationen för bor är:
[Han] 2stvå 2 s1
Den har därför tre valenselektroner. Det krävs ytterligare fem för att slutföra sin valensoktet, och den kan knappt bilda tre kovalenta bindningar; det skulle behöva en fjärde dativlänk för att slutföra sin oktett. Bor kan förlora sina tre elektroner för att förvärva ett oxidationstillstånd på +3.
Erhållande
Bor isoleras genom att reducera borsyra med magnesium eller aluminium; metod liknande den som används av Gay-Lussac och Thénard. Det har svårigheten att förorena bor med boriderna i dessa metaller.
Ett prov med hög renhet kan erhållas genom gasfasreduktion av bortriklorid, eller tribromid, med väte på elektriskt upphettade trådar av tantal..
Bor med hög renhet framställs genom sönderdelning av diboran vid hög temperatur, följt av rening genom zonfusion eller Czocharalski-processer..
Applikationer
Inom industrin
Elementbor har använts vid härdning av stål. I en legering med järn innehållande 0,001 till 0,005% bor. Det används också i den icke-järnhaltiga industrin, vanligtvis som en deoxideringsmedel.
Dessutom används bor som avgasare i koppar med hög ledningsförmåga och kopparbaserade legeringar. I halvledarindustrin tillsätts små mängder bor försiktigt som ett dopningsmedel för kisel och germanium..
Boroxid (BtvåELLER3) blandas med kiseldioxid för att göra ett värmebeständigt glas (borosilikatglas), som används i köksredskap och viss laboratorieutrustning.
Borkarbid (B4C) är en extremt hård substans som används som slipmedel och förstärkningsmedel i kompositmaterial. Aluminiumborid (AlB12) används som ersättning för diamantdamm för slipning och polering.
Bor används i legeringar, till exempel sällsynta jordartsmagneter, genom legering av järn och neodym. De formade magneterna används vid tillverkning av mikrofoner, magnetbrytare, hörlurar och partikelacceleratorer.
Inom medicin
Kapaciteten hos bor-10-isotopen (10B) för att fånga neutroner, emitterande α-typ strålning har använts för behandling av hjärntumörer i en teknik som kallas Borneutron Capture Therapy (BNCT).
De 10Förening B ackumuleras i cancertumören. Därefter bestrålas tumörområdet med neutroner. Dessa interagerar med 10B, vilket orsakar utsläpp av α-partiklar. Dessa partiklar har en hög relativ biologisk effekt och på grund av sin stora storlek har de liten räckvidd..
Därför förblir den destruktiva effekten av α-partiklarna begränsad i tumörcellerna och utför deras förstörelse. BNCT används också vid behandling av cancertumörer i nacken, levern, urinblåsan och prostata..
Biologiska åtgärder
En liten mängd bor, i form av borsyra eller borat, är nödvändig för tillväxt av många växter. En borbrist manifesterar sig i missformad växttillväxt; grönsakernas "bruna hjärta"; och "torrröta" av sockerbetor.
Bor kan behövas i små mängder för att bibehålla benhälsan. Det finns studier som indikerar att bristen på bor skulle vara inblandad i genereringen av artrit. Det skulle också ingripa i hjärnfunktioner såsom minne och hand-öga-koordination.
Vissa experter påpekar att 1,5 till 3 mg bor bör ingå i den dagliga kosten.
Risker och försiktighet
Bor, boroxid, borsyra och borater anses vara giftfria. LD50 för djur är 6 g bor / kg kroppsvikt, medan ämnen med en LD50 som är större än 2 g / kg kroppsvikt anses vara giftfria..
Å andra sidan orsakar konsumtionen av mer än 0,5 mg bor per dag i 50 dagar mindre matsmältningsproblem, vilket tyder på toxicitet. Vissa rapporter tyder på att ett överskott av borintaget kan påverka magsäck, lever, njurar och hjärna.
Dessutom har kortvariga irriterande effekter på nasofarynx, övre luftvägar och ögon rapporterats från exponering för bor..
Rapporter om boroxicitet är knappa och i många fall uppträder toxicitet vid mycket höga doser, högre än de som allmänheten utsätts för..
Rekommendationen är att övervaka borinnehållet i livsmedel, särskilt grönsaker och frukter. Statliga hälsovårdsmyndigheter måste se till att borkoncentrationen i vattnet inte överskrider de tillåtna gränserna..
Arbetare som utsätts för borinnehållande damm bör bära andningsskyddsmasker, handskar och speciella stövlar..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Allotroper av bor. Återställd från: en.wikipedia.org
- Prof. Robert J. Lancashire. (2014). Föreläsning 5b. Elementens struktur (icke-metaller, B, C). Institutionen för kemi, University of the West Indies, Mona Campus, Kingston 7, Jamaica. Återställd från: chem.uwimona.edu.jm
- Manisha Lalloo. (28 januari 2009). Ultra-ren borstruktur upptäckt. Chemistry World. Återställd från: chemistryworld.com
- Bell Terence. (16 december 2018). En profil av metallboret. Återställd från: thebalance.com
- Redaktörerna för Encyclopaedia Britannica. (2019). Bor. Återställd från: britannica.com
- Agency for Toxic Substances and Disease Register. (2010). ToxFAQs på bor. [PDF]. Återställd från: atsdr.cdc.gov
- Helmenstine, Anne Marie, Ph.D. (6 februari 2019). Bor kemiska och fysiska egenskaper. Återställd från: thoughtco.com


Ingen har kommenterat den här artikeln än.