
Butanal struktur, egenskaper, användningsområden och risker
De butanal den är en aldehyd med öppen kedja, som består av fyra kolatomer och är analog med butan; det är faktiskt den näst mest oxiderade formen av kolvätebutan efter smörsyra. Dess molekylformel är CH3CHtvåCHtvåCHO, där -CHO är formylgruppen.
Denna aldehyd, en av de lättaste, består av en transparent, brandfarlig vätska som är mindre tät än vatten. Dessutom är det lösligt i vatten och blandbart med de flesta organiska lösningsmedel; därför kan den användas för att ha enfas organiska blandningar.
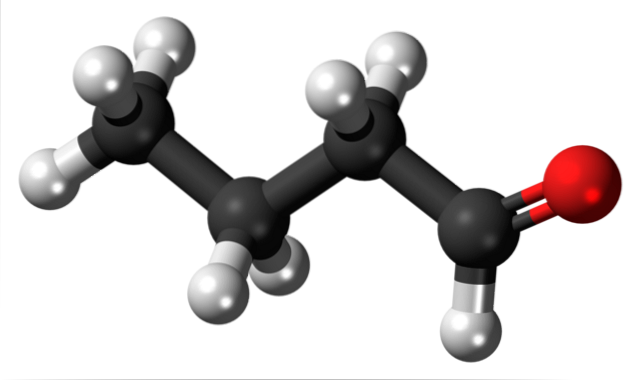
Närvaron av karbonylgruppen (den av den röda sfären, övre bilden) ger kemisk polaritet till butanalmolekylen och därför förmågan att uppleva dipol-dipolinteraktionen mellan dess molekyler; även om inga vätebindningar bildas mellan dem.
Detta resulterar i att butanal har högre kok- och smältpunkter än butan, men lägre än de som presenteras av n-butylalkohol..
Butanal används som lösningsmedel och är en mellanprodukt för att erhålla många produkter; såsom vulkaniseringsacceleratorer för gummi, hartser, läkemedel och jordbrukskemikalier.
Butanal är en giftig förening som vid inandning kan orsaka inflammation i övre luftvägarna, bronkier och lungödem som till och med kan få dödliga konsekvenser..
Artikelindex
- 1 Struktur av butanal
- 1.1 Överensstämmelser
- 2 fastigheter
- 2.1 Kemiska namn
- 2.2 Molekylformel
- 2.3 Fysiskt utseende
- 2.4 Lukt
- 2.5 Kokpunkt
- 2.6 Smältpunkt
- 2.7 Flampunkt
- 2.8 Löslighet i vatten
- 2.9 Löslighet i organiska lösningsmedel
- 2.10 Densitet
- 2.11 Ångdensitet
- 2.12 Ångtryck
- 2.13 Självantändning
- 2.14 Viskositet
- 2.15 Förbränningsvärme
- 2.16 Förångningsvärme
- 2.17 Ytspänning
- 2.18 Lukttröskel
- 2.19 Brytningsindex
- 2.20 Dipolmoment
- 2,21 Våglängder (λ) för maximal absorption i vatten
- 2.22 Polymerisering
- 2.23 Reaktivitet
- 2.24 Aldolkondens
- 3 Syntes
- 4 användningsområden
- 4.1 Industriell
- 4.2 Övriga
- 5 risker
- 6 Referenser
Butanal struktur
Det nämndes just att formylgruppen, -CHO, ger polaritet till butanal- eller butyraldehydmolekylen på grund av den högre elektronegativiteten hos syreatomen. Som ett resultat av detta kan dess molekyler interagera med varandra genom dipol-dipolkrafter..
I den övre bilden visas, med en modell av sfärer och staplar, att butanalmolekylen har en linjär struktur. Kolet i -CHO-gruppen har sp-hybridiseringtvå, medan de återstående kolerna sp hybridiserar3.
Inte bara det, men det är också flexibelt, och dess länkar kan rotera på sina egna axlar; och därmed genereras olika konformationer eller konformationer (samma förening men med sina länkar roterade).
Överensstämmande
Följande bild förklarar bättre denna punkt:
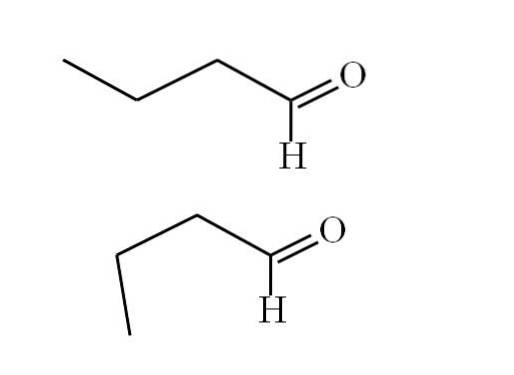
Den första konformern (den övre) motsvarar molekylen i den första bilden: metylgruppen till vänster, -CH3, och gruppen -CHO, är i positioner som är parallella med varandra; den ena pekar uppåt och den andra nedåt.
Under tiden motsvarar den andra konformern (den nedre) molekylen med -CH3 och -CHO i förmörkade positioner; det vill säga de båda pekar i samma riktning.
Båda konformerna är snabbt utbytbara och därför roterar och vibrerar butanalmolekylen ständigt. och lagt till det faktum att den har en permanent dipol, detta gör att dess interaktioner kan vara tillräckligt starka för att koka vid 74,8 ° C..
Egenskaper
Kemiska namn
-Butanal
-Butyraldehyd
-1-Butanal
-Butyral
-N-butyraldehyd.
Molekylär formel
C4H8O eller CH3CHtvåCHtvåCHO.
Fysiskt utseende
Det är en klar, transparent vätska.
Odör
Karakteristisk, skarp, aldehydlukt.
Kokpunkt
167ºF till 760mmHg (74,8ºC).
Smältpunkt
-146 ºF (-96,86 ºC).
antändningspunkt
-8 ° F (-22 ° C) sluten kopp.
Vattenlöslighet
7 g / 100 ml vid 25 ° C.
Löslighet i organiska lösningsmedel
Blandbar med etanol, eter, etylacetat, aceton, toluen och många andra organiska lösningsmedel.
Densitet
0,803 g / cm3 vid 68ºF.
Ång-densitet
2,5 (i förhållande till luft som tas lika med 1).
Ångtryck
111 mmHg vid 25 ºC.
Självantändning
446ºF. 42,8 ºF (21,8 ºC).
Viskositet
0,45 cPoise vid 20 ° C.
Förbränningsvärme
2479,34 kJ / mol vid 25 ºC.
Förångningsvärme
33,68 kJ / mol vid 25 ºC.
Ytspänning
29,9 dyne / cm vid 24 ºC.
Lukttröskel
0,009 ppm.
Brytningsindex
1,3843 vid 20 ºC.
Dipole ögonblick
2,72 D.
Våglängder (λ) för maximal absorption i vatten
225 nm och 282 nm (ultraviolett ljus).
Polymerisation
Butanal kan polymerisera i kontakt med alkalier eller syra, varvid polymerisation är farlig.
Reaktivitet
När det utsätts för luft oxiderar det och bildar smörsyra. Vid en temperatur på 230 ° C antänds butanal spontant med luft.
Aldol kondens
Två molekyler av butanal kan reagera med varandra, i närvaro av KOH och en temperatur av 6-8 ° C, för att bilda föreningen 2-etyl-3-hydroxihexanol. Denna typ av förening kallas aldol, eftersom den i sin struktur har en aldehydgrupp och en alkoholgrupp.
Syntes
Butanal kan framställas genom katalytisk dehydrogenering av n-butylalkohol; den katalytiska hydrogeneringen av krotonaldehyd; och hydroformylering av propylen.
Applikationer
Industriell
-Butanal är ett industriellt lösningsmedel, men det är också en mellanprodukt i syntesen av andra lösningsmedel; till exempel 2-etylhexanol, n-butanol och trimetylpropan.
-Den används också som mellanprodukt vid framställning av syntetiska hartser, inklusive polyvinylbutyral; gummivulkaniseringsacceleratorer; tillverkning av farmaceutiska produkter; växtskyddsmedel; bekämpningsmedel; antioxidanter; garvhjälpmedel.
-Butanal används som råvara för produktion av syntetiska aromer. Dessutom används den som ett livsmedelssmakämne.
Andra
-Hos människa används butanal som en biomarkör som indikerar oxidativ skada upplevd av lipider, proteiner och nukleinsyror.
-Det användes experimentellt, tillsammans med formalin och glutardehyd, för att försöka minska mjukningen av nötkreaturs hovar på grund av exponering för vatten, urin och avföring från nötkreaturen själva. De experimentella resultaten var positiva.
Risker
Butanal är destruktivt för slemhinnor i övre luftvägarna, liksom för vävnader i huden och ögonen..
Vid hudkontakt orsakar rodnad och brännskador. I ögonen uppstår samma skador, åtföljda av smärta och skador på ögonvävnaden.
Inandning av butanal kan få allvarliga konsekvenser, eftersom det kan orsaka inflammation och ödem i struphuvudet och bronkierna; medan det är i lungorna producerar det kemisk lunginflammation och lungödem.
Tecken på överexponering inkluderar: brännande känslor i övre luftvägarna, hosta, väsande andning, dvs. väsande andning vid andning; struphuvud, andfåddhet, huvudvärk, illamående och kräkningar.
Inandning kan vara dödlig till följd av kramp i luftvägarna.
Intag av butanal orsakar en känsla av "brännande" i mag-tarmkanalen: munhålan, svalget, matstrupen och magen.
Referenser
- Morrison, R. T. och Boyd, R. N. (1987). Organisk kemi. (5ta Utgåva.). Ledare Addison-Wesley Iberoamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- PubChem. (2019). Butanal. Återställd från: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Återställd från: es.wikipedia.org
- Kemikaliebok. (2017). Butanal. Återställd från: chemicalbook.com
- Basf. (Maj 2017). N-butyraldehyd. [PDF]. Återställd från: solvents.basf.com



Ingen har kommenterat den här artikeln än.