
Kalciumkarbid (CaC2) struktur, egenskaper, produktion, användningsområden

De kalciumkarbid Det är en oorganisk förening bildad av grundämnena kalcium (Ca) och kol (C). Dess kemiska formel är CaCtvå. Det är ett fast ämne som kan vara färglöst till gulaktigt eller gråvitt och till och med svart beroende på föroreningar det innehåller.
En av dess viktigaste kemiska reaktioner av CaCtvå är vad som händer med vatten HtvåEller i vilken acetylen HC2CH bildas. Av denna anledning används den för att få fram acetylen på ett industriellt sätt. På grund av samma reaktion med vatten används den för att mogna frukter, i falska kanoner och i marinblossar..

CaC-reaktionentvå med vatten producerar också ett användbart slam för att bereda klinker (en komponent av cement), som producerar mindre koldioxid (COtvå) jämfört med den traditionella metoden att producera cement.
Med kväve (Ntvå) kalciumkarbid bildar kalciumcyanamid, som används som gödningsmedel. CaCtvå den används också för att avlägsna svavel från vissa metalllegeringar.
För en tid sedan var CaCtvå Den användes i så kallade hårdmetallampor, men de är inte så vanliga längre eftersom de är farliga.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Kemiska egenskaper
- 4 Skaffa
- 5 användningsområden
- 5.1 Vid framställning av acetylen
- 5.2 Att minska koldioxidutsläppen
- 5.3 Vid erhållande av kalciumcyanamid
- 5.4 Inom metallindustrin
- 5.5 I olika användningsområden
- 5.6 Avbruten användning
- 6 risker
- 7 Referenser
Strukturera
Kalciumkarbid är en jonförening och består av kalciumjonen Catvå+ och karbiden eller acetylidjonen Ctvåtvå-. Karbidjonen består av två kolatomer förenade med en trippelbindning.
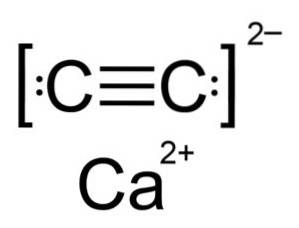
Kristallstrukturen hos CaCtvå härrör från kubik (som natriumklorid NaCl), men som C-jontvåtvå- är långsträckt är strukturen förvrängd och blir tetragonal.
Nomenklatur
- Kalciumkarbid
- Kalciumkarbid
- Kalciumacetylid
Egenskaper
Fysiskt tillstånd
Kristallint fast ämne som när det är rent är färglöst, men om det är förorenat med andra föreningar kan det vara gulvitt eller gråaktigt till svart.

Molekylvikt
64,0992 g / mol
Smältpunkt
2160 ºC
Kokpunkt
CaCtvå den kokar vid 2300 ºC med sönderdelning. Kokpunkten måste mätas under en inert atmosfär, det vill säga utan syre eller fukt..
Densitet
2,22 g / cm3
Kemiska egenskaper
Kalciumkarbid reagerar med vatten för att bilda acetylen HC2CH och kalciumhydroxid Ca (OH)två:
CaCtvå + 2 timmartvåO → HC2CH + Ca (OH)två
Acetylen är brandfarligt, därför CaC i närvaro av fukttvå det kan vara brandfarligt. Men när det är torrt är det inte.

Kalciumkarbid reagerar med kväve Ntvå för att bilda kalciumcyanamid CaCNtvå:
CaCtvå + Ntvå → CaCNtvå + C
Erhållande
Kalciumkarbid produceras industriellt i en elektrisk bågugn med utgångspunkt från en blandning av kalciumkarbonat (CaCO3) och kol (C) som utsätts för en temperatur av 2000 ° C. Reaktionen sammanfattas så här:
Tjuv3 + 3 C → CaCtvå + CO ↑ + COtvå↑
Eller också:
CaO + 3 C → CaCtvå + CO ↑
I en elektrisk ljusbågsugn produceras en ljusbåge mellan två grafitelektroder, som motstår de höga temperaturer som bildas. En kalciumkarbid med 80-85% renhet erhålls.
Applikationer
Vid framställning av acetylen
Industriellt används reaktionen av kalciumkarbid med vatten för att framställa acetylen CtvåHtvå.
CaCtvå + 2 timmartvåO → HC2CH + Ca (OH)två
Detta är den viktigaste användningen av kalciumkarbid. I vissa länder är acetylen högt värderad, eftersom det gör det möjligt att producera polyvinylklorid, som är en plasttyp. Dessutom används acetylen för att svetsa vid höga temperaturer.

För att minska koldioxidutsläppentvå
Resterna erhållna från erhållande av acetylen med utgångspunkt från CaCtvå (även kallat "kalciumkarbidslam" eller "kalciumkarbidrester") används för att erhålla klinker eller betong.
Kalciumkarbidslera har ett högt innehåll av kalciumhydroxid (Ca (OH)två(cirka 90%), en del kalciumkarbonat (CaCO3) och har ett pH större än 12.

Av dessa skäl kan den reagera med SiOtvå eller AltvåELLER3 bilda en produkt liknande den som erhålls genom cementhydratiseringsprocessen.
En av de mänskliga aktiviteter som ger mest koldioxidutsläpptvå det är byggbranschen. Kompaniettvå genereras i öst lossnar från kalciumkarbonat under reaktionen för att bilda betong.
Använda kalciumkarbidslam för att ersätta kalciumkarbonat (CaCO3) har visat sig minska koldioxidutsläppentvå med 39%.
Vid erhållande av kalciumcyanamid
Kalciumkarbid används också industriellt för att erhålla kalciumcyanamid CaCNtvå.
CaCtvå + Ntvå → CaCNtvå + C
Kalciumcyanamid används som gödningsmedel, eftersom det med jordvattnet omvandlas till cyanamid H2N = C = N, vilket ger kväve till växter, ett viktigt näringsämne för dem.
Inom metallindustrin
Kalciumkarbid används för att avlägsna svavel från legeringar som ferronikel. CaC blandastvå med legeringen smält vid 1550 ° C Svavel (S) reagerar med kalciumkarbid och producerar kalciumsulfid CaS och kol C:
CaCtvå + S → 2 C + CaS
Svavelavlägsnande är gynnsamt om blandningen är effektiv och kolhalten i legeringen är låg. Kalciumsulfiden CaS flyter på ytan av den smälta legeringen varifrån den dekanteras och kastas..
I olika användningsområden
Kalciumkarbid har använts för att avlägsna svavel från järn. Också som bränsle vid stålproduktion och som en kraftfull deoxideringsmedel.
Det används för att mogna frukt. Acetylen genereras från kalciumkarbid med vatten, vilket inducerar mogning av frukt, såsom bananer..

Kalciumkarbid används i dummypistoler för att orsaka det höga smällljudet som kännetecknar dem. Här används också bildandet av acetylen, som exploderar med en gnista inuti enheten.
CaCtvå används för att generera signaler offshore i självantändande marinblossar.
Avbruten användning
CaCtvå den har använts i så kallade hårdmetallampor. Driften av dessa består av droppande vatten på kalciumkarbiden för att bilda acetylen, som antänds och ger på detta sätt ljus.
Dessa lampor användes i kolgruvor, men deras användning avbröts på grund av närvaron av metangasen CH4 i dessa gruvor. Denna gas är brandfarlig och lågan från hårdmetallampan kan få den att antändas eller explodera..

De användes i stor utsträckning i skiffer-, koppar- och tennberggruvor, och även i tidiga bilar, motorcyklar och cyklar, som strålkastare eller strålkastare.
För närvarande har de ersatts av elektriska lampor eller till och med LED-lampor. De används dock fortfarande i länder som Bolivia, i silvergruvorna i Potosí.
Risker
Kalciumkarbid CaCtvå torrt är det inte brandfarligt men i närvaro av fukt bildar det snabbt acetylen, vilket det är.
Att släcka en brand i närvaro av CaCtvå vatten, skum, koldioxid eller halogensläckare ska aldrig användas. Sand eller natrium eller kalciumhydroxid bör användas.
Referenser
- Ropp, R.C. (2013). Grupp 14 (C, Si, Ge, Sn och Pb) Alkaliska jordföreningar. Kalciumkarbider. I Encyclopedia of the Alkaline Earth Compounds. Återställd från sciencedirect.com.
- Pohanish, R. P. (2017). C. Kalciumkarbid. I Sittigs handbok om giftiga och farliga kemikalier och cancerframkallande ämnen (sjunde upplagan). Återställd från sciencedirect.com.
- Sun, H. et al. (2015). Egenskaper hos kemiskt förbränt kalciumkarbidrester och dess inverkan på cementegenskaper. Material 2015, 8, 638-651. Återställd från ncbi.nlm.nih.gov.
- Nie, Z. (2016). Miljömaterial och livscykelbedömning. Fallstudie: COtvå Utsläppsanalys av kalciumkarbidslamklinker. I grön och hållbar tillverkning av avancerat material. Återställd från sciencedirect.com.
- Crundwell, F.K. Et al. (2011). Raffinering av smält ferronickel. Svavelavlägsnande. I extraherande metallurgi av nickel-, kobolt- och platinagruppmetaller. Återställd från sciencedirect.com.
- Tressler, R.E. (2001). Strukturell och termostrukturell keramik. Karbider. I Encyclopedia of Materials Science and Technology. Återställd från sciencedirect.com.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.



Ingen har kommenterat den här artikeln än.