
Arseninsyra (H3AsO4) egenskaper, risker och användningar
De arseniksyra, vätearsenat eller ortoarsensyra, är en kemisk förening vars formel är H3AsO4. En arseniksyra innefattar en oxogrupp och tre hydroxylgrupper bundna till en central arsenikatom. Dess struktur presenteras i figur 1 (CHEBI: 18231 - arsenic acid, S.F.).
Dess struktur är analog med fosforsyra (Royal Society of Chemistry, 2015) och kan skrivas om som AsO (OH) 3. Denna förening framställs genom att behandla arseniktrioxid med kväveoxid enligt reaktionen: As2O3 + 2HNO3 + 2H2O → 2H3AsO4 + N2O3.
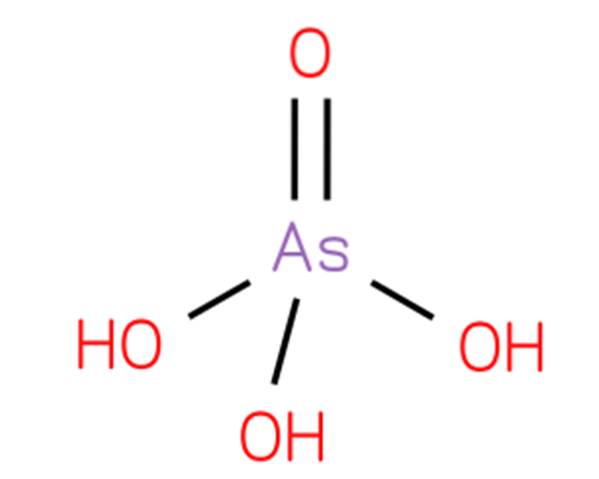
Den erhållna lösningen kyls för att ge färglösa kristaller av hemihydrat H3AsO4 · ½H2O, även om dihydratet H3AsO4 · 2H2O inträffar när kristallisation äger rum vid lägre temperaturer (Budavari, 1996).
Arseninsyra är en extremt giftig förening. Många säkerhetsdatablad rekommenderar att man undviker kontakt om möjligt.
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos arsenik
- 2 Reaktivitet och faror
- 2.1 Vid kontakt med ögonen
- 2.2 Vid hudkontakt
- 2.3 Vid förtäring
- 2.4 Vid inandning
- 3 användningsområden
- 4 Referenser
Fysikaliska och kemiska egenskaper hos arseniksyra
Arseninsyra är ett vitt hygroskopiskt fast ämne. Dess utseende visas i figur 2.

I vattenlösning är det en viskös och transparent hygroskopisk vätska (National Center for Biotechnology Information., 2017). Dess molekylvikt är 141,94 g / mol och densiteten är 2,5 g / ml. Dess smältpunkt är 35,5 ° C och dess kokpunkt är 120 ° C där den sönderdelas.
Arseniksyra är mycket löslig i vatten och kan lösas upp 16,7 g per 100 ml, den är också löslig i alkohol. Föreningen har en pKa på 2,19 för den första deprotoneringen och 6,94 och 11,5 för den andra och tredje deprotoneringen (Royal Society of Chemistry, 2015).
Arseninsyra är ett oxidationsmedel. Kan korrodera stål och reagerar med galvaniserade metaller och mässing.
Arsenisyralösningar kan utveckla mycket giftigt gasformigt arsin (AsH3) vid kontakt med aktiva metaller, såsom zink och aluminium. Vid uppvärmning till nedbrytning producerar den giftiga ångor av metallisk arsenik.
Lösningen är lätt sur och ett svagt oxidationsmedel. Reagerar med alkalier för att generera lite värme och fälla ut arsenat (ARSENSYRA, VÄTSKA, 2016).
Reaktivitet och faror
Arseninsyra är en stabil, icke-brännbar förening som kan vara frätande för metaller. Föreningen är mycket giftig och bekräftad cancerframkallande för människor.
Inandning, förtäring eller hudkontakt med material kan orsaka allvarliga skador eller dödsfall. Kontakt med det smälta ämnet kan orsaka svåra brännskador på hud och ögon..
Undvik hudkontakt. Effekterna av kontakt eller inandning kan försenas. Brand kan orsaka irriterande, frätande och / eller giftiga gaser. Avloppsvatten från brandbekämpning eller utspädning kan vara frätande och / eller giftigt och orsaka kontaminering.
Symtom på arsenikförgiftning är hosta och andfåddhet vid inandning. Det kan också vara rodnad på huden, smärta och en brännande känsla om den kommer i kontakt med den. Slutligen är symtomen vid förtäring rodnad och smärta i ögonen, halsont, illamående, kräkningar, diarré och kramper..
Vid kontakt med ögonen
De bör tvättas med mycket vatten i minst 15 minuter och lyfta de övre och nedre ögonlocken sporadiskt tills det inte finns några tecken på kemiska rester..
Vid hudkontakt
Tvätta genast med mycket tvål och vatten i minst 15 minuter medan du tar bort förorenade kläder och skor. Täck brännskador med ett torrt sterilt bandage (säkert, inte tätt).
Vid förtäring
Skölj munnen och ge medvetna offer med stora mängder vatten för att späda ut syran. I detta fall ska magspolning användas och kräkningar ska inte induceras..
Vid inandning
Artificiell andning bör ges vid behov. Munt-till-mun-metoden ska inte användas om offret har intagit eller inandat ämnet..
Konstgjord andning ska utföras med hjälp av en fickmask försedd med envägsventil eller annan lämplig andningsmedicinsk utrustning. Offret ska flyttas till en sval plats och hållas varm och i vila..
I alla fall bör omedelbar läkarvård sökas (National Institute for Occupational Safety and Health, 2015).
Arseniksyra är skadligt för miljön. Ämnet är mycket giftigt för vattenlevande organismer. Åtgärder bör vidtas för att begränsa frisättningen av denna kemiska förening.
Applikationer
Arseniksyra, med tanke på dess höga toxicitet, har begränsad användning. Denna förening användes dock som bekämpningsmedel och jordsteriliserande, även om den för närvarande är föråldrad (University of Hertfordshire, 2016).
Det har också använts vid träbearbetning och som torkmedel vid bomullsproduktion sedan 1995. Sprutning av växterna gör att bladen torkar snabbt utan att falla av. Växten måste vara tillräckligt torr så att bomullsbollarna lätt kan komma ut.
Arseninsyra används vid produktion av glas. Även om uppgifterna betraktar ämnet som en mellanprodukt verkar denna användning av arsenik mer som ett "bearbetningsmedel", liknar användningen av diarsenisk trioxid (As2O3) som ett efterbehandlingsmedel..
Denna förening bryter syrebindningarna mellan andra element genom redoxreaktionen och producerar gasformigt syre som hjälper till att eliminera bubblor i glaset (Positionspapper från European Glass Industries on, 2012).
Arsanilinsyra eller 4-aminofenylarsonsyra är ett derivat av ortoarsensyra. Det används som ett arseniskt antibakteriellt veterinärmedicin som används för att förebygga och behandla svindysenteri (ARSENIC ACID, S.F.).
Arsenat är saltet eller estern av arseniksyra som har en negativ jon av AsO43-. Arsenat liknar fosfat på många sätt, eftersom arsenik och fosfor förekommer i samma grupp (kolumn) i det periodiska systemet..
Arsenat kan ersätta oorganiskt fosfat i glykolysstadiet som producerar 1,3-bisfosfoglycerat och producerar istället 1-arsenik-3-fosfoglycerat. Denna molekyl är instabil och hydrolyserar snabbt och bildar nästa mellanprodukt längs vägen, 3-fosfoglycerat..
Därför fortsätter glykolysen, men ATP-molekylen som skulle genereras från 1,3-bisfosfoglycerat går förlorad. Arsenat är en glykolysavkopplare, vilket förklarar dess toxicitet.
Vissa arter av bakterier får sin energi genom att oxidera olika bränslen samtidigt som arsenat reduceras till arseniter. De involverade enzymerna är kända som arsenatreduktaser..
2008 upptäcktes bakterier som använder en version av fotosyntes med arseniter som elektrondonatorer, vilket producerar arsenat (precis som vanlig fotosyntes använder vatten som elektrondonator och producerar molekylärt syre).
Forskare antog att historiskt sett producerade dessa fotosyntetiska organismer arsenatet som gjorde att de arsenatreducerande bakterierna trivdes (Human Metabolome Database, 2017).
Referenser
- ARSENSYRA. (S.F.). Återställd från chemicalland21.com.
- ARSENSYRA, VÄTSKA. (2016). Återställd från cameochemicals.noaa.gov.
- Budavari, S. (. (1996). Merck Index - En Encyclopedia of Chemicals, Drugs and Biologicals. Whitehouse Station, NJ: Merck and Co.
- CHEBI: 18231 - arseniksyra. (S.F.). Återställd från ebi.ac.uk.
- Human Metabolome Database. (2017, 2 mars). Visar metabokort för arsenat. Återställd från hmdb.ca.
- Nationellt centrum för bioteknikinformation ... (2017, 4 mars). PubChem Compound Database; CID = 234,. Hämtad från PubChem.
- National Institute for Occupational Safety and Health. (2015, 22 juli). ARSENSYRA. Återställd från cdc.gov.
- Positionspapper från Europeiska glasindustrin på. (2012, 18 september). Återställd från glassallianceeurope.
- Royal Society of Chemistry. (2015). Arseninsyra. Återställd från chemspider.
- Royal Society of Chemistry. (2015). Fosforsyra. Återställd från chemspider.
- University of Hertfordshire. (2016, 13 januari). arseniksyra. Återställd från PPDB.


Ingen har kommenterat den här artikeln än.