
Salpetersyra (HNO3) struktur, egenskaper, syntes och användningar
De salpetersyra Det är en oorganisk förening som består av kväveoxosyra. Det anses vara en stark syra, även om dess pKa (-1,4) liknar pKa för hydroniumjonen (-1,74). Från och med denna punkt är det kanske den "svagaste" av många kända starka syror..
Dess fysiska utseende består av en färglös vätska som vid lagring ändras till en gulaktig färg på grund av bildandet av kvävgas. Dess kemiska formel är HNO3.

Det är något instabilt, genomgår lätt nedbrytning från exponering för solljus. Dessutom kan den sönderdelas helt genom uppvärmning, vilket ger upphov till kvävedioxid, vatten och syre..
Bilden ovan visar lite salpetersyra i en mätkolv. Dess gula färg kan märkas, vilket indikerar en partiell sönderdelning.
Det används vid tillverkning av oorganiska och organiska nitrater, liksom i nitrosoföreningar som används vid tillverkning av gödselmedel, sprängämnen, mellanprodukter för färgämnen och olika organiska kemiska föreningar..
Denna syra var redan känd för alkemisterna på 800-talet, som de kallade "agua fortis". Den tyska kemisten Johan Rudolf Glauber (1648) designade en metod för dess framställning, som bestod av att värma kaliumnitrat med svavelsyra.
Den bereds industriellt enligt metoden som designats av Wilhelm Oswald (1901). Metoden består i allmänhet av den katalytiska oxidationen av ammonium, med den successiva genereringen av kväveoxid och kvävedioxid för att bilda salpetersyra..
I atmosfären, NEJtvå som produceras av mänsklig aktivitet reagerar med molnvatten och bildar HNO3. Sedan, under sura regn, fälls den ut tillsammans med vattendroppar och äter bort till exempel statyer på offentliga torg..
Salpetersyra är en mycket giftig förening, och kontinuerlig exponering för ångorna kan leda till kronisk bronkit och kemisk lunginflammation..
Artikelindex
- 1 Strukturen av salpetersyra
- 1.1 Resonansstrukturer
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Kemiska namn
- 2.2 Molekylvikt
- 2.3 Fysiskt utseende
- 2.4 Lukt
- 2.5 Kokpunkt
- 2.6 Smältpunkt
- 2.7 Löslighet i vatten
- 2.8 Densitet
- 2.9 Relativ densitet
- 2.10 Relativ ångdensitet
- 2.11 Ångtryck
- 2.12 Sönderfall
- 2.13 Viskositet
- 2.14 Korrosion
- 2.15 Molar förångning
- 2.16 Standard molär entalpi
- 2.17 Standard molär entropi
- 2.18 Ytspänning
- 2.19 Lukttröskel
- 2.20 Dissociationskonstant
- 2.21 Brytningsindex (η / D)
- 2.22 Kemiska reaktioner
- 3 Syntes
- 3.1 Industri
- 3.2 I laboratoriet
- 4 användningsområden
- 4.1 Gödselproduktion
- 4.2 Industriell
- 4.3 Metallrenare
- 4.4 Aqua regia
- 4.5 Möbler
- 4.6 Rengöring
- 4.7 Fotografering
- 4.8 Andra
- 5 Toxicitet
- 6 Referenser
Salpetersyrastruktur
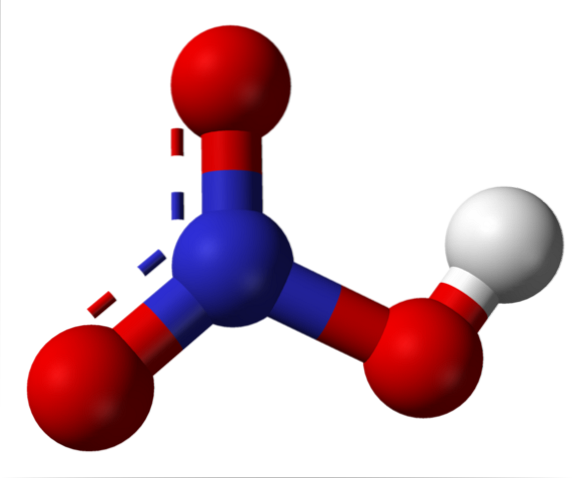
Den övre bilden visar strukturen för en HNO-molekyl.3 med en modell av kulor och stänger. Kväveatomen, den blå sfären, ligger i mitten, omgiven av en trigonal plangeometri; triangeln är dock förvrängd av en av dess längsta hörn.
Salpetersyramolekyler är sedan platta. N-O-, N-O- och N-OH-bindningarna utgör topparna i den plana triangeln. Om det observeras i detalj är N-OH-bindningen mer långsträckt än de andra två (där den vita sfären som representerar H-atomen finns).
Resonansstrukturer
Det finns två bindningar som har samma längd: N = O och N-O. Detta faktum strider mot valensbindningsteorin, där dubbelbindningar förutses vara kortare än enkelbindningar. Förklaringen till detta ligger i fenomenet resonans, vilket framgår av bilden nedan.

Båda obligationerna, N = O och N-O, är därför ekvivalenta när det gäller resonans. Detta visas grafiskt i strukturmodellen med en streckad linje mellan två O-atomer (se struktur).
När HNO deprotoneras3, den stabila anjonnitrat NO bildas3-. I det involverar nu resonansen alla tre O-atomerna. Detta är anledningen till att HNO3 har hög Bronsted-Lowry-surhet (H-donatorart+).
Fysiska och kemiska egenskaper
Kemiska namn
-Salpetersyra
-Azotisk syra
-Väte-nitrat
-Fortis vatten.
Molekylvikt
63,012 g / mol.
Fysiskt utseende
Färglös eller blekgul vätska som kan bli rödbrun.
Odör
Skarp, kvävande egenskap.
Kokpunkt
181ºF till 760mmHg (83ºC).
Smältpunkt
-41,6 ºC.
Vattenlöslighet
Mycket löslig och blandbar med vatten.
Densitet
1,513 g / cm3 vid 20 ºC.
Relativ densitet
1,50 (i förhållande till vatten = 1).
Relativ ångdensitet
2 eller 3 gånger uppskattat (i förhållande till luft = 1).
Ångtryck
63,1 mmHg vid 25 ºC.
Sönderfall
Vid exponering för atmosfärisk fukt eller värme kan den sönderdelas för att bilda kväveperoxid. Vid uppvärmning till sönderdelning avger den en mycket giftig rök av kväveoxid och vätenitrat..
Salpetersyra är inte stabil, den kan sönderdelas i kontakt med värme och exponering för solljus och avger kvävedioxid, syre och vatten..
Viskositet
1092 mPa vid 0 ° C och 0,617 mPa vid 40 ° C.
Korrosion
Den kan angripa alla basmetaller utom aluminium och kromstål. Angriper några av sorterna av plast, gummi och beläggning. Det är ett frätande och frätande ämne, så det måste hanteras med extrem försiktighet.
Molar förångningsentalpi
39,1 kJ / mol vid 25 ºC.
Standard molär entalpi
-207 kJ / mol (298 ºF).
Standard molär entropi
146 kJ / mol (298 ºF).
Ytspänning
-0,04356 N / m vid 0 ºC
-0,04115 N / m vid 20 ºC
-0,0376 N / m vid 40 ºC
Lukttröskel
-Låg lukt: 0,75 mg / m3
-Hög lukt: 250 mg / m3
-Irriterande koncentration: 155 mg / m3.
Dissociationskonstant
pKa = -1,38.
Brytningsindex (η / D)
1,393 (16,5 ºC).
Kemiska reaktioner
Hydrering
-Kan bilda fasta hydrater, såsom HNO3∙ HtvåO och HNO3∙ 3HtvåEller: "salpetersyra".
Dissociation i vatten
Salpetersyra är en stark syra som joniserar snabbt i vatten enligt följande:
HNO3 (l) + HtvåO (l) => H3ELLER+ (ac) + NEJ3-
Saltbildning
Reagerar med basiska oxider för att bilda ett nitratsalt och vatten.
CaO (s) + 2 HNO3 (l) => Ca (NO3)två (ac) + HtvåO (l)
På samma sätt reagerar det med baser (hydroxider) och bildar ett salt av nitrat och vatten..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HtvåO (l)
Och även med karbonater och syrakarbonater (bikarbonater), som också bildar koldioxid.
NatvåCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HtvåO (l) + COtvå (g)
Protonation
Salpetersyra kan också fungera som en bas. Av denna anledning kan den reagera med svavelsyra.
HNO3 + 2HtvåSW4 <=> INTEtvå+ + H3ELLER+ + 2HSO4-
Autoprotolys
Salpetersyra genomgår autoprotolys.
2HNO3 <=> INTEtvå+ + INTE3- + HtvåELLER
Metalloxidation
I reaktionen med metaller beter sig salpetersyra inte som starka syror, som reagerar med metaller, bildar motsvarande salt och frigör väte i gasform..
Men magnesium och mangan reagerar varmt med salpetersyra, precis som de andra starka syrorna gör..
Mg (s) + 2 HNO3 (l) => Mg (NO3)två (ac) + Htvå (g)
Övrig
Salpetersyra reagerar med metallsulfiter och bildar ett nitratsalt, svaveldioxid och vatten..
NatvåSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOtvå (g) + HtvåO (l)
Och det reagerar också med organiska föreningar och ersätter en nitrogrupp med väte; utgör således grunden för syntesen av explosiva föreningar såsom nitroglycerin och trinitrotoluen (TNT).
Syntes
Industriell
Det produceras på industriell nivå genom katalytisk oxidation av ammonium, enligt metoden som beskrivs av Oswald 1901. Förfarandet består av tre steg eller steg.
Steg 1: Oxidation av ammonium till kväveoxid
Ammoniak oxideras av syre i luften. Reaktionen utförs vid 800 ° C och vid ett tryck av 6-7 atm, med användning av platina som katalysator. Ammoniak blandas med luft med följande förhållande: 1 volym ammoniak per 8 volymer luft.
4NH3 (g) + 5Otvå (g) => 4NO (g) + 6HtvåO (l)
Kväveoxid produceras i reaktionen, som tas till oxidationskammaren för nästa steg..
Steg 2. Oxidation av kväveoxid till kvävedioxid
Oxidationen utförs av syret som finns i luften vid en temperatur under 100 ºC.
2NO (g) + Otvå (g) => 2NOtvå (g)
Steg 3. Upplösning av kvävedioxid i vatten
I detta steg uppstår bildandet av salpetersyra.
4NOtvå + 2HtvåO + Otvå => 4HNO3
Det finns flera metoder för absorption av kvävedioxid (NOtvå) i vatten.
Bland andra metoder: NEJtvå är dimeriserad till NtvåELLER4 vid låga temperaturer och högt tryck för att öka dess löslighet i vatten och producera salpetersyra.
3NtvåELLER4 + 2HtvåO => 4HNO3 + 2NO
Salpetersyran som produceras genom oxidation av ammoniak har en koncentration mellan 50-70%, vilket kan bringas till 98% genom att använda koncentrerad svavelsyra som ett uttorkningsmedel, vilket gör att koncentrationen av salpetersyra kan ökas..
På laboratoriet
Termisk sönderdelning av koppar (II) nitrat, som producerar kvävedioxid och syrgas som passerar genom vatten för att bilda salpetersyra; som i Oswald-metoden, som tidigare beskrivits.
2Cu (NO3)två => 2CuO + 4NOtvå + ELLERtvå
Reaktion av ett nitratsalt med HtvåSW4 koncentrerad. Den bildade salpetersyran separeras från HtvåSW4 genom destillation vid 83 ° C (salpetersyras kokpunkt).
KNO3 + HtvåSW4 => HNO3 + KHSO4
Applikationer
Gödselproduktion
60% av salpetersyraproduktionen används vid tillverkning av gödselmedel, särskilt ammoniumnitrat.
Detta kännetecknas av sin höga koncentration av kväve, en av de tre viktigaste växtnäringsämnena, nitrat används omedelbart av växterna. Samtidigt oxideras ammoniak av de mikroorganismer som finns i jorden och används som ett långvarigt gödningsmedel..
Industriell
-15% av salpetersyraproduktionen används vid tillverkning av syntetiska fibrer.
-Det används vid framställning av salpetersyraestrar och nitroderivat; såsom nitrocellulosa, akrylfärger, nitrobensen, nitrotoluen, akrylnitriler, etc..
-Det kan lägga nitrogrupper till organiska föreningar, och den här egenskapen kan användas för att framställa sprängämnen som nitroglycerin och trinitrotoluen (TNT)..
-Adipinsyra, en föregångare till nylon, produceras i stor skala genom oxidation av cyklohexanon och cyklohexanol med salpetersyra..
Metallrenare
Salpetersyra, på grund av dess oxidationsförmåga, är mycket användbar vid rening av metaller som finns i mineraler. På samma sätt används den för att erhålla element såsom uran, mangan, niob, zirkonium och vid försurning av fosforsyra för att erhålla fosforsyra..
Kungligt vatten
Det blandas med koncentrerad saltsyra för att bilda "aqua regia". Denna lösning kan lösa upp guld och platina, vilket möjliggör dess användning vid rening av dessa metaller..
möbel
Salpetersyra används för att få en antik effekt i möbler tillverkade av furu. Behandling med en 10% salpetersyralösning ger en grå-guldfärgning i möbelns trä.
Rengöring
-Blandningen av vattenhaltiga lösningar av salpetersyra 5-30% och fosforsyra 15-40% används vid rengöring av utrustningen som används vid mjölkningsarbetet för att eliminera resterna av fällningarna av magnesium och kalciumföreningar.
-Det är användbart vid rengöring av glas som används i laboratoriet.
Fotografi
-Salpetersyra har använts vid fotografering, speciellt som en tillsats till järnsulfatutvecklare i våtplattaprocessen, för att främja en vitare färg i ambrotyper och färgtoner..
-Det användes för att sänka pH i silverbadet på kollodionsplattorna, vilket möjliggjorde en minskning av utseendet på en dimma som stör bilderna.
Andra
-På grund av dess lösningsmedelskapacitet används den vid analys av olika metaller med hjälp av flamatomabsorptionsspektrofotometritekniker och induktivt kopplad plasmamasspektrofotometri..
-Kombinationen av salpetersyra och svavelsyra användes för omvandling av vanlig bomull till cellulosanitrat (salpetersyra).
-Läkemedlet Salcoderm för extern användning används vid behandling av godartade tumörer i huden (vårtor, liktornar, kondylom och papillom). Den har egenskaper för kauterisering, smärtlindring, irritation och klåda. Salpetersyra är huvudkomponenten i läkemedelsformeln.
-Rödrökande salpetersyra och vitrökande salpetersyra används som oxidationsmedel för flytande raketbränslen, särskilt i BOMARC-missilen..
Giftighet
-I kontakt med huden kan det orsaka brännskador på huden, svår smärta och dermatit..
-Vid kontakt med ögonen kan det orsaka svår smärta, riva och i svåra fall hornhinneskador och blindhet..
-Inandning av ångorna kan orsaka hosta, andningsbesvär, orsaka näsblod, struphuvud, kronisk bronkit, lunginflammation och lungödem vid svår eller kronisk exponering..
-På grund av dess intag finns det lesioner i munnen, salivation, intensiv törst, smärta att svälja, intensiv smärta genom matsmältningskanalen och risk för perforering av densamma..
Referenser
- Wikipedia. (2018). Salpetersyra. Återställd från: en.wikipedia.org
- PubChem. (2018). Salpetersyra. Återställd från: pubchem.ncbi.nlm.nih.gov
- Redaktörerna för Encyclopaedia Britannica. (23 november 2018). Salpetersyra. Encyclopædia Britannica. Återställd från: britannica.com
- Shrestha B. (s.f.). Egenskaper hos salpetersyra och användningsområden. Chem Guide: självstudier för kemilärande. Återställd från: chem-guide.blogspot.com
- Kemikaliebok. (2017). Salpetersyra. Återställd från: chemicalbook.com
- Imanol. (10 september 2013). Salpetersyraproduktion. Återställd från: ingenieriaquimica.net



Ingen har kommenterat den här artikeln än.