
Kromsyras struktur, egenskaper, produktion, användningsområden

De kromsyra eller HtvåCrO4 det är teoretiskt syran associerad med krom (VI) oxid eller kromoxid CrO3. Detta namn beror på att arten HtvåCrO4 är närvarande tillsammans med andra arter av krom (VI).
Kromoxid CrO3 det kallas också vattenfri kromsyra. CrO3 är en rödbrun eller lila fast substans som erhålls genom behandling av lösningar av kalium K-dikromattvåCrtvåELLER7 med svavelsyra HtvåSW4.

Vattenhaltiga kromoxidlösningar upplever en jämvikt mellan vissa kemiska arter vars koncentration beror på lösningens pH. Vid grundläggande pH dominerar kromatjonerna CrO4två-, medan vid surt pH dominerar HCrO-jonerna4- och Cr-dikromattvåELLER7två-. Det uppskattas att vid surt pH är kromsyra H också närvarandetvåCrO4.
På grund av sin stora oxidationsförmåga används kromsyralösningar i organisk kemi för att utföra oxidationsreaktioner. De används också i elektrokemiska processer för att behandla metaller på ett sätt som gör dem motståndskraftiga mot korrosion och slitage..
Vissa polymera material behandlas också med kromsyra för att förbättra deras vidhäftning till metaller, färger och andra ämnen..
Kromsyralösningar är mycket farliga för människor, de flesta djur och miljön. Av detta skäl behandlas flytande eller fast avfall från processer där kromsyra används för att avlägsna spår av krom (VI) eller för att återvinna allt närvarande krom och regenerera kromsyran för återanvändning..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Densitet
- 3.5 Löslighet
- 3.6 Övriga egenskaper
- 4 Kemi av vattenlösningar där kromsyra är närvarande
- 5 Skaffa
- 6 Användningar av kromsyra
- 6.1 Vid oxidation av kemiska föreningar
- 6.2 I metallanodiseringsprocesser
- 6.3 Vid kemiska omvandlingsbehandlingar
- 6.4 På eroderade eller gropiga ytor
- 6.5 I olika användningsområden
- 7 Kromsyraåtervinning
- 7.1 Genom att använda hartser
- 7.2 Genom elektrokemisk regenerering
- 8 Användning av mikroorganismer för att rengöra avloppsvatten med spår av kromsyra
- 9 Risker med kromsyra och kromoxid
- 10 Referenser
Strukturera
Kromsyramolekyl HtvåCrO4 den bildas av en kromatjon CrO4två- och två vätejoner H+ bifogas detta. I kromatjonen är grundämnet Krom i ett oxidationstillstånd på +6.
Den rumsliga strukturen för kromatjonen är tetraeder, där krom är i centrum och oxygener upptar tetraederns fyra hörn..
I kromsyra är väteatomerna vardera tillsammans med ett syre. Av de fyra krombindningarna med syreatomerna är två dubbla och två enkla, eftersom de har vätena fästa vid dem.
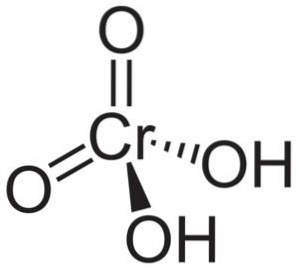
Å andra sidan kromoxid CrO3 har en kromatom i +6 oxidationstillstånd omgiven av endast tre syreatomer.
Nomenklatur
- Kromsyra HtvåCrO4
- Tetraoxokrominsyra HtvåCrO4
- Kromoxid (vattenfri kromsyra) CrO3
- Kromtrioxid (vattenfri kromsyra) CrO3
Egenskaper
Fysiskt tillstånd
Vattenfri kromsyra eller kromoxid är en lila till röd kristallin fast substans
Molekylvikt
CrO3: 118,01 g / mol
Smältpunkt
CrO3: 196 ºC
Över dess smältpunkt är den termiskt instabil, den tappar syre (reduceras) för att ge krom (III) oxid CrtvåELLER3. Den sönderdelas vid cirka 250 ºC.
Densitet
CrO3: 1,67-2,82 g / cm3
Löslighet
CrO3 det är mycket lösligt i vatten: 169 g / 100 g vatten vid 25 ºC.
Det är lösligt i mineralsyror som svavelsyra och salpetersyra. Löslig i alkohol.
Andra egenskaper
CrO3 den är väldigt hygroskopisk, dess kristaller är delikat.
När CrO3 upplöses i vatten bildar starkt sura lösningar.
Det är en mycket kraftfull oxidant. Oxiderar kraftigt organiskt material i nästan alla dess former. Angriper tyg, läder och lite plast. Angriper också de flesta metaller.
Det är starkt giftigt och mycket irriterande på grund av dess höga oxidationsförmåga..
Kemi av vattenlösningar där kromsyra är närvarande
Kromoxid CrO3 löser sig snabbt i vatten. I vattenlösning kan krom (VI) existera under olika jonformer.
Vid pH> 6,5 eller i alkalisk lösning förvärvar krom (VI) kromatjonformen CrO4två- gul.
Om pH sänks (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , som kan dimerisera till Cr-dikromatjontvåELLER7två-, och lösningen blir orange. Vid pH mellan 2,5 och 5,5 är den dominerande arten HCrO4- och CRtvåELLER7två-.

Balanserna som uppstår i dessa lösningar när pH sjunker är följande:
CrO4två- (kromatjon) + H+ ⇔ HCrO4-
HCrO4- + H+ ⇔ HtvåCrO4 (kromsyra)
2HCrO4- ⇔ CrtvåELLER7två- (dikromatjon) + HtvåELLER
Dessa balanser uppträder endast om den syra som tillsätts för att sänka pH är HNO3 eller HClO4, eftersom med andra syror bildas olika föreningar.
Sura dikromatlösningar är mycket starka oxidationsmedel. Men i alkaliska lösningar är kromatjonen mycket mindre oxiderande.
Erhållande
Enligt de källor som konsulterats är ett av sätten att erhålla kromoxid CrO3, Detta består i att tillsätta svavelsyra till en vattenlösning av natrium- eller kaliumdikromat och bilda en röd-orange fällning..

Kromsyra HtvåCrO4 Det finns i vattenlösningar av kromoxid i ett surt medium.
Kromsyra använder
Vid oxidation av kemiska föreningar
På grund av sin starkt oxiderande förmåga har kromsyra länge använts framgångsrikt för att oxidera organiska och oorganiska föreningar..
Bland otaliga exempel är följande: det gör det möjligt att oxidera primära alkoholer till aldehyder och dessa till karboxylsyror, sekundära alkoholer till ketoner, toluen till bensoesyra, etylbensen till acetofenon, trifenylmetan till trifenylkarbinol, myrsyra till COtvå, oxalsyra till COtvå, mjölksyra till acetaldehyd och COtvå, ferrojon Fetvå+ till ferjonjon Fe3+, jodidjon till jod, etc.
Det möjliggör omvandling av nitrosoföreningar till nitroföreningar, sulfider till sulfoner. Det är inblandat i syntesen av ketoner med utgångspunkt från alkener, eftersom det oxiderar hydroborerade alkener till ketoner.
Föreningar som är mycket resistenta mot vanliga oxidationsmedel, såsom syre Otvå eller väteperoxid HtvåELLERtvå, de oxideras av kromsyra. Detta är fallet för vissa heterocykliska boraner.
I metallanodiseringsprocesser
Kromsyraanodisering är en elektrokemisk behandling som appliceras på aluminium för att skydda den under många år från oxidation, korrosion och slitage..
Anodiseringsprocessen innefattar den elektrokemiska bildningen av ett lager av aluminiumoxid eller aluminiumoxid på metallen. Detta skikt förseglas sedan i varmt vatten, med vilket omvandlingen till aluminiumoxidtrihydrat uppnås..
Det förseglade oxidskiktet är tjockt, men strukturellt svagt och inte särskilt tillfredsställande för efterföljande limbindning. Att tillsätta en liten mängd kromsyra i tätningsvattnet utvecklar emellertid en yta som kan bilda bra bindningar..
Kromsyran i tätningsvattnet löser upp en del av den grova cellliknande strukturen och lämnar ett tunt, starkt, fast fästat lager av aluminiumoxid, till vilket limet fäster och bildar starka och hållbara bindningar..
Anodisering av kromsyra gäller även titan och dess legeringar.
Vid kemiska omvandlingsbehandlingar
Kromsyra används i metallbeläggningsprocesser genom kemisk omvandling.
Under denna process nedsänks metaller i kromsyralösningar. Detta reagerar och upplöser delvis ytan medan det deponerar ett tunt lager av komplexa kromföreningar som interagerar med basmetallen..
Denna process kallas kromatkonverteringsbeläggning eller konverteringsförkromning..
Metallerna som i allmänhet utsätts för omvandlingsförkromning är olika typer av stål, såsom kolstål, rostfritt stål och zinkbelagt stål, och olika icke-järnmetaller, såsom magnesiumlegeringar, tennlegeringar, aluminiumlegeringar, koppar. , kadmium, mangan och silver.
Denna behandling ger korrosionsbeständighet och glans till metallen. Ju högre pH i processen, desto större är korrosionsbeständigheten. Temperaturen accelererar syrareaktionen.
Beläggningar i olika färger kan appliceras, såsom blå, svart, guld, gul och klar. Det ger också bättre vidhäftning av metallytan till färger och lim.
På eroderade eller gropiga ytor
Kromsyralösningar används vid beredning av ytan på föremål tillverkade av termoplastiskt material, härdade polymerer och elastomerer för deras efterföljande beläggning med färger eller lim..
HtvåCrO4 det har en inverkan på ytans kemi och dess struktur, eftersom det hjälper till att öka dess grovhet. Kombinationen av grop och oxidation ökar limens penetration och kan till och med orsaka förändringar i polymerens egenskaper..
Den har använts för att erodera grenad lågdensitetspolyeten, linjär högdensitetspolyeten och polypropen.
Det används i stor utsträckning inom elektropläterings- eller elektropläteringsindustrin för att underlätta metallpolymervidhäftning.
I olika användningsområden
Kromsyra används som träkonserveringsmedel, även i magnetiska material och för katalys av kemiska reaktioner.
Kromsyraåtervinning
Det finns många processer som använder kromsyra och genererar strömmar eller rester som innehåller krom (III) som inte kan kasseras på grund av att de har mycket (VI) joner som är mycket giftiga och inte heller kan återanvändas eftersom koncentrationen av kromatjoner är mycket låg..
Deras bortskaffande kräver kemisk reduktion av kromater till krom (III), följt av utfällning av hydroxiden och filtrering, vilket genererar ytterligare kostnader.
Av denna anledning har olika metoder studerats för att ta bort och återvinna kromat. Här är några av dessa.
Genom att använda hartser
Jonbytarhartser har använts i många år för behandling av vatten som är förorenat med kromat. Detta är en av de behandlingar som godkänts av US Environmental Protection Agency, eller EPA. Naturvårdsverket).
Denna metod möjliggör utvinning av koncentrerad kromsyra eftersom den regenereras igen från hartset..
Hartserna kan vara starka eller svaga. I starkt basiska hartser kan kromaten avlägsnas på grund av HCrO-jonerna4- och CRtvåELLER7två- utbyts med OH-joner- och Cl-. I svagt basiska hartser, till exempel sulfathartser, utbyts joner med SO4två-.
När det gäller de starkt basiska R- (OH) hartserna är de totala reaktionerna följande:
2ROH + HCrO4- + H+ ⇔ RtvåCrO4 + 2HtvåELLER
RtvåCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4två-
RtvåCrO4 + HCrO4- + H+ ⇔ RtvåCrtvåELLER7 + HtvåELLER
För varje mol av RtvåCrO4 konverteras avlägsnas en mol Cr (VI) från lösningen, vilket gör denna metod mycket attraktiv..
Efter avlägsnande av kromaterna behandlas hartset med en starkt alkalisk lösning för att regenerera dem på en säker plats. Därefter omvandlas kromaterna till koncentrerad kromsyra som ska återanvändas..
Genom elektrokemisk regenerering
En annan metod är elektrokemisk regenerering av kromsyra, vilket också är ett mycket bekvämt alternativ. Genom denna process oxideras krom (III) anodiskt till krom (VI). Anodmaterialet är i dessa fall företrädesvis blydioxid..
Användning av mikroorganismer för att rengöra utflöden med spår av kromsyra
En metod som har undersökts och fortfarande studeras är användningen av mikroorganismer som är naturligt närvarande i vissa avloppsvatten som är kontaminerade med sexvärda kromjoner, vilka är de som finns i kromsyralösningar..

Så är fallet med vissa bakterier som finns i avloppsvatten från lädergarvning. Dessa mikrober har studerats och det har fastställts att de är resistenta mot kromater och också kan reducera krom (VI) till krom (III) vilket är mycket mindre skadligt för miljön och levande varelser..
Av denna anledning uppskattas att de kan användas som en miljövänlig metod för sanering och avgiftning av avloppsvatten som är kontaminerade med spår av kromsyra..
Krom- och kromoxidrisker
CrO3 Det är inte brännbart men det kan intensifiera förbränningen av andra ämnen. Många av deras reaktioner kan orsaka brand eller explosion.
CrO3 och kromsyralösningar är potenta irriterande på huden (kan orsaka dermatit), ögon (kan brinna) och slemhinnor (kan orsaka bronkoasma) och kan orsaka så kallade "kromhål" i andningsorganen.
Krom (VI) -föreningar som kromsyra och kromoxid är allvarligt giftiga, mutagena och cancerframkallande för de flesta levande saker..
Referenser
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- USA National Library of Medicine. (2019). Kromsyra. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. och Van Twisk, J. (2013). Aluminium och aluminiumlegeringar. 2.5. Kromsyraanodiseringsprocess. In Surface Preparation Techniques for Adhesive Bonding (Second Edition). Återställd från sciencedirect.com.
- Wegman, R.F. och Van Twisk, J. (2013). Magnesium. 6.4. Framställning av magnesium- och magnesiumlegeringar med kromsyrabehandlingsprocesser. In Surface Preparation Techniques for Adhesive Bonding (Second Edition). Återställd från sciencedirect.com.
- Grot, W. (2011). Applikationer. 5.1.8. Regenerering av kromsyra. In Fluorinated Ionomers (andra upplagan). Återställd från sciencedirect.com.
- Swift, K.G. och Booker, J.D. (2013). Ytteknikprocesser. 9.7. Kromatering. I handbok för val av tillverkningsprocess. Återställd från sciencedirect.com.
- Poulsson, A.H.C. et al. (2019). Ytmodifieringstekniker för PEEK, inklusive plasmaytbehandling. 11.3.2.1. Ytetsning. I PEEK Biomaterials Handbook (andra upplagan). Återställd från sciencedirect.com.
- Westheimer, F.H. (1949). Mekanismerna för kromsyraoxidationer. Kemiska recensioner 1949, 45, 3, 419-451. Återställd från pubs.acs.org.
- Tan, H.K.S. (1999). Borttagning av kromsyra av Anion Exchange. Canadian Journal of Chemical Engineering, volym 77, februari 1999. Återställd från onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Isolering och karakterisering av krom (VI) -reducerande bakterier från garvavlopp och fast avfall. World Journal of Microbiology and Biotechnology (2018) 34: 126. Återställd från ncbi.nlm.nih.gov.
Ingen har kommenterat den här artikeln än.