
Hyposulfurösa syraformler, egenskaper och användningsområden
De svavelsyra eller tionionsyra är okänd, instabil i ren form, har ingen oberoende existens och har inte detekterats i vattenlösning.
Teoretiskt skulle det vara en relativt svag syra, jämförbar med svavelsyra, H2SO3. Endast dess salter är kända, ditioniterna, som är stabila och kraftfulla reduktionsmedel. Natriumsaltet av ditionsyra är natriumditionit.

- Formler
| tionionsyra | ditionitanjon | natriumditionit | |
| Formler | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 hyposulfurous (eller ditionous) syra
- CAS: 14844-07-6 hyposulfurous acid (eller ditionous, ion)
- CAS: 7775-14-6 natriumditionit (natriumsalt av dinionsyra)
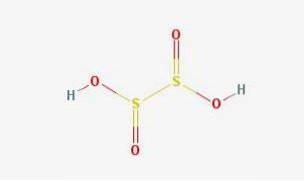
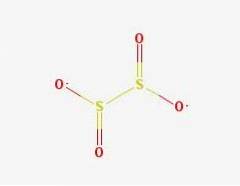
2D-struktur
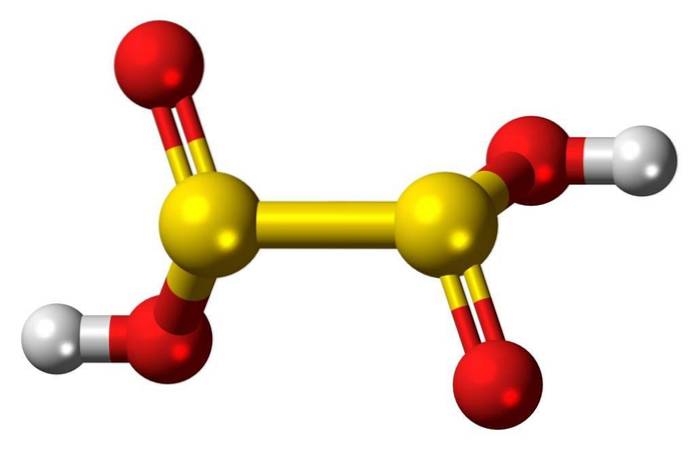
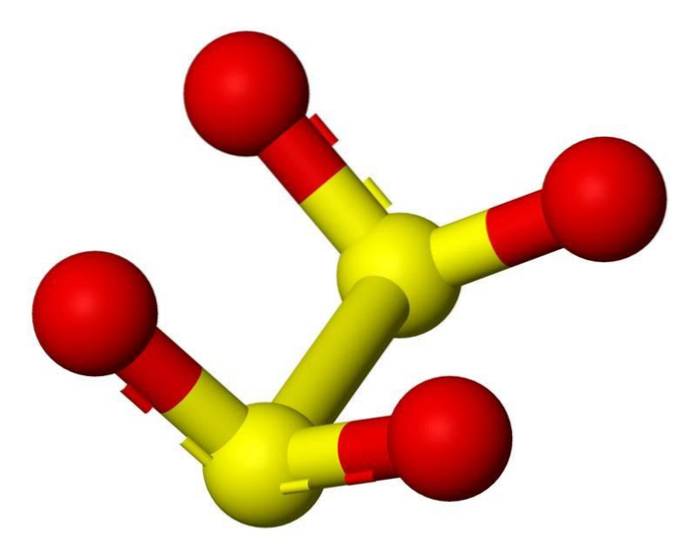
3D-struktur
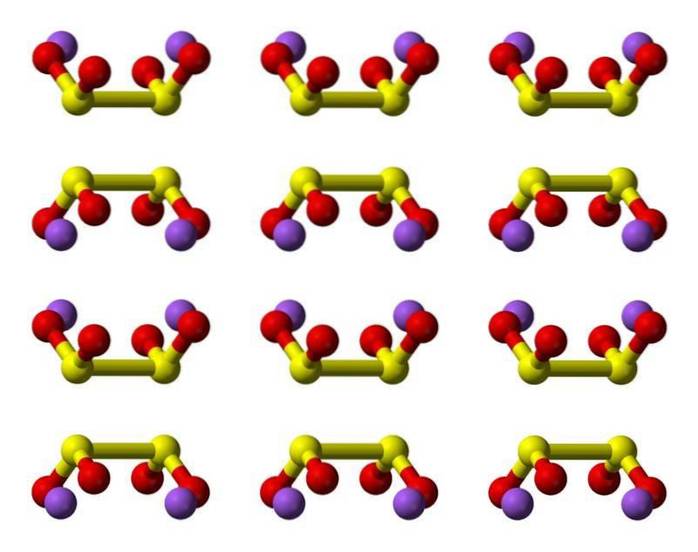
Egenskaper
Fysiska och kemiska egenskaper
| tionionsyra | ditionitanjon | natriumditionit | |
| Utseende: | . | . | Vitt till benvitt kristallint pulver |
| . | . | Lätta citronflingor | |
| Odör: | . | . | Svag svavellukt |
| Molekylvikt: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Kokpunkt: | . | . | Det sönderfaller |
| Smältpunkt: | . | . | 52 ° C |
| Densitet: | . | . | 2,38 g / cm3 (vattenfri) |
| Vattenlöslighet | . | . | 18,2 g / 100 ml (vattenfri, 20 ° C) |
Hyposulfurous acid är en svaveloxosyra med den kemiska formeln H2S2O4.
Svaveloxosyror är kemiska föreningar som innehåller svavel, syre och väte. Några av dem är emellertid endast kända från sina salter (såsom svavelsyra, ditionsyra, disulfidsyra och svavelsyra).
Bland de strukturella egenskaperna hos oxosyrorna som har karakteriserats har vi:
- Tetrahedral svavel när det samordnas med syre
- Bro- och terminala syreatomer
- Terminalperoxogrupper
- S = S-terminaler
- Strängar av (-S-) n
Svavelsyra är den mest kända svaveloxosyran och den viktigaste industriellt.
Ditionitanjonen ([S2O4] 2-) är en oxoanjon (en jon med den generiska formeln AXOY z-) av svavel som formellt härrör från ditionsyra.
Ditionitjoner genomgår både sur och alkalisk hydrolys till tiosulfat respektive bisulfit respektive sulfit och sulfid:
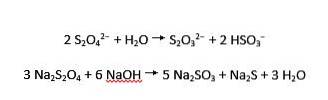
Natriumsaltet av ditionsyra är natriumditionit (även känt som natriumhydrosulfit).
Sodium ditionit är ett vitaktigt till ljusgult kristallint pulver som har en lukt som liknar svaveldioxid..
Det värms upp spontant vid kontakt med luft och fukt. Denna värme kan räcka för att antända de omgivande brännbara materialen..
Vid långvarig exponering för eld eller intensiv värme kan behållare med detta material brista våldsamt..
Det används som reduktionsmedel och som blekmedel. Det används och för blekning av pappersmassa och vid färgning. Det används också för att reducera nitrogruppen till en aminogrupp i organiska reaktioner..
Även om det är stabilt under de flesta förhållanden sönderdelas det i varmvatten- och syralösningar.
Det kan erhållas från natriumbisulfit genom följande reaktion:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ^
Luft- och vattenreaktioner
Natriumditionit är ett brännbart fast ämne som sönderdelas långsamt vid kontakt med vatten eller vattenånga och bildar tiosulfater och bisulfiter..
Denna reaktion ger värme, vilket ytterligare kan påskynda reaktionen eller orsaka omgivande material att brinna. Om blandningen är begränsad kan sönderdelningsreaktionen resultera i trycksättning av behållaren, vilket kan brista kraftigt. Stannar i luften oxiderar den långsamt och genererar giftiga svaveldioxidgaser.
Brandrisk
Natriumditionit är ett brandfarligt och brännbart material. Kan antändas vid kontakt med fuktig luft eller fukt. Det kan brinna snabbt med flareeffekt. Kan reagera kraftigt eller explosivt i kontakt med vatten.
Kan sönderdelas explosivt vid uppvärmning eller brand. Det kan antändas igen efter att branden har släckts. Avrinning kan skapa brand eller explosionsrisk. Behållare kan explodera vid uppvärmning.
Hälsorisk
Vid kontakt med eld kommer natriumditionit att ge irriterande, frätande och / eller giftiga gaser. Inandning av sönderdelningsprodukter kan orsaka allvarlig personskada eller dödsfall. Kontakt med ämnet kan orsaka svåra hud- och ögonskador. Avrinning från brandkontroll kan orsaka föroreningar.
Applikationer
Ditionitjonen används, ofta i kombination med ett komplexbildande medel (t.ex. citronsyra), för att reducera järn (III) oxihydroxid till lösliga järn (II) -föreningar och avlägsna amorfa järninnehållande mineralfaser (III) i jordanalys (selektiv extraktion ).
Ditionit ökar lösligheten av järn. Tack vare den starka affiniteten hos ditionjonen för tvåvärda och trevärda metallkatjoner används den som ett kelatbildande medel..
Sönderdelningen av ditionit ger reducerade svavelarter som kan vara mycket aggressiva för korrosion av stål och rostfritt stål..
Bland tillämpningarna av natriumditionit har vi:
Inom industrin
Denna förening är ett vattenlösligt salt och kan användas som reduktionsmedel i vattenlösningar. Det används som sådant i vissa industriella färgningsprocesser, huvudsakligen de som involverar svavelfärger och karfärgämnen, där ett vattenolösligt färgämne kan reduceras till ett vattenlösligt alkalimetallsalt (till exempel indigofärgämnet).
De reducerande egenskaperna hos natriumditionit avlägsnar också överflödigt färgämne, kvarvarande oxid och oönskade pigment, vilket förbättrar den totala färgkvaliteten..
Natriumditionit kan också användas för vattenbehandling, gasrening, rengöring och extraktion. Det kan också användas i industriella processer som ett sulfoneringsmedel eller en källa för natriumjon.
Förutom textilindustrin används denna förening i industrier relaterade till läder, mat, polymerer, fotografi och många andra. Används också som blekmedel i organiska reaktioner.
Inom biologiska vetenskaper
Natriumditionit används ofta i fysiologiska experiment som ett sätt att minska lösningarnas redoxpotential..
I geologiska vetenskaper
Natriumditionit används ofta i jordkemiska experiment för att bestämma mängden järn som inte ingår i primära silikatmineraler..
Säkerhet och risker
Faroangivelser från det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS)
Det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS) är ett internationellt överenskommet system, skapat av FN och utformat för att ersätta de olika klassificerings- och märkningsstandarder som används i olika länder genom att använda enhetliga kriterier globalt..
Faroklasserna (och deras motsvarande GHS-kapitel), klassificerings- och märkningsstandarder och rekommendationer för natriumditionit är följande (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):



Referenser
- Benjah-bmm27, (2006). En kul-och-stick-modell av ditionitjonen [bild] Återställd från wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., & Steiger, T. (1998). Strukturer och energier hos olika isomerer av dinionsyra, H2S2O4 och dess anjon HS2O4-1. Journal of Physical Chemistry A, 102 (6), 990-996. Återställd från: mycrandall.ca
- Europeiska kemikaliemyndigheten (ECHA). (2017). Sammanfattning av klassificering och märkning. Harmoniserad klassificering - Bilaga VI till förordning (EG) nr 1272/2008 (CLP-förordningen). Natriumditionit, natriumhydrosulfit. Hämtad den 2 februari 2017 från: echa.europa.eu
- Jynto (diskussion), (2011). Dithionous-acid-3D-balls [image] Återställd från: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Exempel på natriumditionit [bild] Återställd från: wikipedia.org.
- Mills, B. (2009). Sodium-ditionite-xtal-1992-3D-balls [image] Återställd från: wikipedia.org.
- FN (2015). Globalt harmoniserat system för klassificering och märkning av kemikalier (GHS) Sjätte reviderade utgåvan. New York, EU: FN: s publikation. Återställd från: unece.orgl
- Nationellt centrum för bioteknikinformation. PubChem Compound Database. (2017). Ditionit. Bethesda, MD, EU: National Library of Medicine. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database. (2017). Dithionous syra. Bethesda, MD, EU: National Library of Medicine. Återställd från: nih.gov.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database. (2017). Sodium ditionitee. Bethesda, MD, EU: National Library of Medicine. Återställd från: nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kemiskt datablad. Natrium ditionit. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov
- PubChem, (2016). Dithionit [bild] Återställd från: nih.gov.
- PubChem, (2016). Dithionit [bild] Återställd från: nih.gov.
- PubChem, (2016). Dithionous acid [image] Återställd från: nih.gov.
- Wikipedia. (2017). Ditionit. Hämtad 2 februari 2017 från: wikipedia.org.
- Wikipedia. (2017). Dithionous_acid. Hämtad 2 februari 2017 från: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Hämtad 2 februari 2017 från: wikipedia.org.
- Wikipedia. (2017). Natrium ditionit. Hämtad 2 februari 2017 från: wikipedia.org.
- Wikipedia. (2017). Svaveloxosyra. Hämtad 2 februari 2017 från: wikipedia.org.


Ingen har kommenterat den här artikeln än.