
Hydrojodsyra (HI) struktur, egenskaper och användningsområden

De hydrojodsyra Det är en vattenlösning av vätejodid som kännetecknas av dess höga surhet. En definition närmare den kemiska och IUPAC-terminologin är att det är en hydracid, vars kemiska formel är HI.
För att skilja det från gasformiga vätejodidmolekyler betecknas emellertid HI (g) HI (aq). Det är av den anledningen att det i kemiska ekvationer är viktigt att identifiera den medium eller fysiska fas i vilken reaktanterna och produkterna finns. Ändå är förvirring mellan vätejodid och hydrojodsyra vanlig..
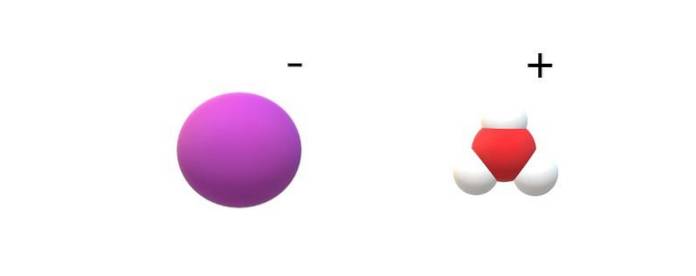
Om molekylerna som begås i sin identitet observeras kommer märkbara skillnader att hittas mellan HI (g) och HI (ac). I HI (g) finns en H-I-bindning; medan de är i HI (ac) är de faktiskt ett jonpar I- och H3ELLER+ interagerar elektrostatiskt (toppbild).
Å andra sidan är HI (ac) en källa till HI (g), eftersom den första bereds genom att lösa den andra i vatten. På grund av detta, såvida det inte finns i en kemisk ekvation, kan HI också användas för att hänvisa till hydrojodsyra. HI är ett starkt reduktionsmedel och en utmärkt källa till I-joner.- i vattenhaltigt medium.
Artikelindex
- 1 Struktur av hydrojodsyra
- 2 fastigheter
- 2.1 Fysisk beskrivning
- 2.2 Molekylär massa
- 2.3 Lukt
- 2.4 Densitet
- 2.5 Kokpunkt
- 2,6 pKa
- 2.7 Surhet
- 2.8 Reduktionsmedel
- 3 Nomenklatur
- 4 användningsområden
- 4.1 Jodkälla i organiska och oorganiska synteser
- 4.2 Reduktionsmedel
- 4.3 Cativa-process
- 4.4 Olagliga synteser
- 5 Referenser
Struktur av hydrojodsyra
Hydrojodsyra, som just förklarats, består av en lösning av HI i vatten. Att vara i vatten, HI-molekylerna dissocierar helt (stark elektrolyt), med ursprung i I-jonerna- och H3ELLER+. Denna dissociation kan representeras av följande kemiska ekvation:
HI (g) + HtvåO (l) => I-(ac) + H3ELLER+(ac)
Vad skulle vara ekvivalent om det skrevs som:
HI (g) + HtvåO (l) => HI (ac)
HI (ac) avslöjar dock inte alls vad som har hänt med de gasformiga HI-molekylerna; det indikerar bara att de är i ett vattenhaltigt medium.
Därför består den sanna strukturen för HI (ac) av jonerna I- och H3ELLER+ omgiven av vattenmolekyler som hydrerar dem; ju mer koncentrerad hydrojodsyra desto lägre är antalet oprotonerade vattenmolekyler.
Kommersiellt är HI-koncentrationen faktiskt 48 till 57% i vatten; mer koncentrerad skulle motsvara att ha för rökande syra (och ännu farligare).
På bilden kan man se att anjonen jag- representeras av en lila sfär och H3ELLER+ med vita kulor och en röd för syreatomen. Katjonen H3ELLER+ har trigonal pyramidmolekylgeometri (sett från ett högre plan i bilden).
Egenskaper
Fysisk beskrivning
Färglös vätska; men den kan uppvisa gulaktiga och bruna toner om den är i direktkontakt med syre. Detta beror på att jonerna jag- slutar oxidera till molekylär jod, jagtvå. Om det finns mycket jagtvå, det är mer än troligt att triiodidanjonen bildas, I3-, som fläckar lösningen brun.
Molekylär massa
127,91 g / mol.
Odör
Tunnland.
Densitet
Densiteten är 1,70 g / ml för 57% HI-lösningen; eftersom densiteterna varierar beroende på de olika koncentrationerna av HI. Vid denna koncentration bildas en azeotrop (den destilleras som en enda substans och inte som en blandning) till vars relativa stabilitet det kan bero på dess kommersialisering jämfört med andra lösningar..
Kokpunkt
57% HI-azeotropen kokar vid 127 ° C vid ett tryck av 1,03 bar (GO TO ATM).
pKa
-1,78.
Aciditet
Det är en extremt stark syra, så mycket att den är frätande för alla metaller och tyger; även för gummi.
Detta beror på att H-I-bindningen är mycket svag och den bryts lätt under jonisering i vatten. Dessutom vätebindningar I- - HOHtvå+ är svaga, så det finns inget som stör H3ELLER+ reagera med andra föreningar; det vill säga H3ELLER+ har varit "gratis", som jag- det lockar inte med för mycket kraft till hans motverkan.
Reduktionsmedel
HI är ett kraftfullt reduktionsmedel, vars huvudreaktionsprodukt är Itvå.
Nomenklatur
Nomenklaturen för hydrojodsyra härrör från det faktum att jod "fungerar" med ett enda oxidationstillstånd: -1. Och också, samma namn indikerar att det har vatten inom sin strukturformel [I-] [H3ELLER+]. Detta är dess enda namn, eftersom det inte är en ren förening utan en lösning.
Applikationer
Jodkälla i organiska och oorganiska synteser
HI är en utmärkt källa till joner I- för oorganiska och organiska synteser, och är också ett kraftfullt reduktionsmedel. Till exempel används dess 57% vattenhaltiga lösning för syntes av alkyljodider (såsom CH3CHtvåI) från primära alkoholer. På samma sätt kan en OH-grupp ersättas med en I i en struktur.
Reduktionsmedel
Hydrojodsyra har använts för att minska till exempel kolhydrater. Om glukos upplöst i denna syra upphettas kommer den att förlora alla sina OH-grupper och erhålla kolväte n-hexan som en produkt..
På samma sätt har den använts för att reducera de funktionella grupperna av grafenark, på ett sådant sätt att de kan funktionaliseras för elektroniska enheter..
Cativa-processen

Steg
Processen börjar (1) med organo-iridiumkomplexet [Ir (CO)tvåJagtvå]-, kvadratisk plan geometri. Denna förening "mottar" metyljodid, CH3I, produkt av försurning av CH3OH med 57% HI. Vatten produceras också i denna reaktion, och tack vare den erhålls ättiksyra äntligen, samtidigt som HI kan återvinnas i det sista steget..
I detta steg både gruppen -CH3 som -I de binder till iridiummetallcentret (2) och bildar ett oktaedrisk komplex med en fasett bestående av tre I-ligander. En av joderna ersätts med en molekyl av kolmonoxid, CO; och nu (3) har det oktaedriska komplexet en fasett som består av tre CO-ligander.
Då inträffar en omläggning: -CH-gruppen3 den "lossnar" från Ir och binder till intilliggande CO (4) för att bilda en acetylgrupp, -COCH3. Denna grupp frisätts från iridiumkomplexet för att binda till jodidjoner och ge CH3COI, acetyljodid. Här utvinns iridiumkatalysatorn, redo att delta i en annan katalytisk cykel.
Slutligen CH3IOC genomgår en ersättning av I- per en molekyl av HtvåO, vars mekanism slutar frigöra HI och ättiksyra.
Olagliga synteser

Det kan ses att en substitution av OH-gruppen mot I sker först, följt av en andra substitution för en H.
Referenser
- Wikipedia. (2019). Hydrojodsyra. Återställd från: en.wikipedia.org
- Andrews, Natalie. (24 april 2017). Användningen av vätskesyra. Sciencing. Återställd från: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydronsyra. Återställd från: alfa.com
- Nationellt centrum för bioteknikinformation. (2019). Hydronsyra. PubChem Database., CID = 24841. Återställd från: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Illustrerad ordlista för organisk kemi: vätejodsyra. Återställd från: chem.ucla.edu
- Reusch William. (5 maj 2013). Kolhydrater. Återställd från: 2.chemistry.msu.edu
- I Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Minskad grafenoxid genom kemisk grafitisering. DOI: 10.1038 / ncomms1067.

Ingen har kommenterat den här artikeln än.