
Starka och svaga syror och baser

En klassificering av syror och baser i kemi beror på joniseringskraften hos dessa ämnen i vattenhaltigt medium. A) Ja:
- a syra och en bas är starka när de är helt joniserade, det vill säga i joniseringsprocessen transformeras de fullständigt till katjoner eller positiva joner och till anjoner eller negativa joner.
- Å andra sidan, en syra och en bas är svaga när de är delvis joniserade i vatten, det vill säga i lösning, kommer det att finnas en andel katjoner, en annan andel anjoner och en annan andel oskiljade molekyler.
| Starka syror och baser | Svaga syror och baser | |
|---|---|---|
| Definition | Ämnen som helt joniseras i lösning. | Ämnen som delvis joniserar i lösning. |
| Jonisering | Komplett | Partiell |
| Element i vattenlösning | Katjoner och anjoner i samma koncentration. | Katjoner, anjoner och molekyler i olika proportioner. |
| Joniseringskonstant | Upphöjd | Liten |
| Exempel |
|
|
Starka syror och baser
A syra eller en bas är starka när de i ett vattenhaltigt medium dissocieras helt, joniseringsprocessen är fullständig och lösningen har samma koncentration av anjoner som katjoner.
Hur joniserar du en syra och en stark bas??
En stark syra, såsom saltsyra-HCl, joniserar på följande sätt:
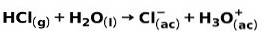
En stark bas, såsom natriumhydroxid NaOH, joniserar på följande sätt:
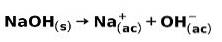
Exempel på starka syror och deras formler
| Starka syror | Formel |
|---|---|
| Saltsyra | HCl |
| Svavelsyra | HtvåSW4 |
| Salpetersyra | HNO3 |
| Bromvätesyra | HBr |
| Perklorsyra | HClO4 |
| Kromsyra | HtvåCrO4 |
| Tetrafluroborinsyra | HBF4 |
Exempel på starka baser och deras formler
| Stark bas | Formel |
|---|---|
| Natriumhydroxid | NaOH |
| Litiumhydroxid | LiOH |
| Kaliumhydroxid | KOH |
| Rubidiumhydroxid | RbOH |
| Cesiumhydroxid | CsOH |
| Kalcium hydroxid | Ca (OH)två |
| Bariumhydroxid | Ba (OH)två |
| Strontiumhydroxid | Sr (OH)två |
| Aluminiumhydroxid | Al (OH)3 |
Du kanske är intresserad av att se fler exempel på syror och baser.
Svaga syror och baser
A Syra eller bas är svag när den är delvis joniserad i vattenlösning, det vill säga i lösningen finns joner och icke-joniserade molekyler.
Hur joniserar man en syra och en svag bas??
En svag syra, såsom ättiksyra CH3COOH, joniseras på följande sätt:
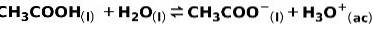
Jämvikten i denna reaktion uttrycks av de två pilarna i motsatta riktningar.
När en svag syra dissocieras eller joniseras, upprättas en jämvikt mellan de arter som finns i lösningen; detta kan uttryckas av a joniseringskonstant sur:
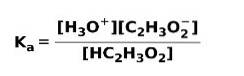
Joniseringskonstanten är inget annat än förhållandet mellan multipliceringen av koncentrationen av produkterna över multipliceringen av koncentrationen av reaktanterna.
En svag bas, såsom NH-ammoniak3, joniseras på följande sätt:
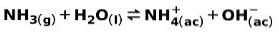
När en svag bas dissocieras eller joniseras, upprättas en jämvikt mellan de arter som finns i lösningen; detta kan uttryckas av a basjoniseringskonstant:
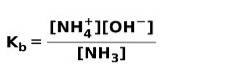
Du kanske är intresserad av att känna till skillnaden mellan syror och baser.
Exempel på svaga syror med deras formel och syrajoniseringskonstant Ktill
| Svag syra | Formel | Joniseringskonstant |
|---|---|---|
| Myrsyra | HtvåCOtvå | 1,77 x 10-4 |
| Ättiksyra | H3CCOH | 1,75 x 10-5 |
| Hydrocyansyra | HOCN | 3,30 x 10-4 |
| Vätecyanid | HCN | 6,20 x 10-10 |
| Hypoklorsyra | HOCl | 3,50 x 10-8 |
| Salpetersyra | HNOtvå | 4,00 x 10-4 |
| Mjölksyra | HC3H5ELLER3 | 1,40 x 10-4 |
| Kolsyra | HtvåCO3 | 4,30 x 10-7 5,60 x 10-elva |
| Borsyra | H3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Exempel på svaga baser med deras formel och grundläggande joniseringskonstant Kb
| Svag bas | Formel | Joniseringskonstant |
|---|---|---|
| Ammoniak | NH3 | 1,75 x 10-5 |
| Metylamin | CH3NHtvå | 4,38 x 10-4 |
| Etylamin | CtvåH5NHtvå | 5,60 x 10-4 |
| Anilin | C6H5NHtvå | 3,80 x 10-10 |
| Pyridin | C5H5N | 1,70 x 10-9 |
| Bensylamin | C7H9N | 2,20 x 10-5 |
| Natriumbikarbonat | NaHCO | 2,00 x 10-4 |
Du kanske är intresserad av att veta mer om syror och basers egenskaper


Ingen har kommenterat den här artikeln än.