
Vätecyanidmolekylär struktur, egenskaper, användningsområden
De hydrocyansyra eller cyanväte är en organisk förening vars kemiska formel är HCN. Det är också känt som metanonitril eller formonitril och, fram till för flera år sedan, som preussinsyra, även om detta faktiskt är en annan förening.
Hydrocyansyra är en extremt giftig, färglös gas som erhålls genom att behandla cyanider med syror. Denna syra finns i persikafröna, även känd som persikor..

Vid en omgivningstemperatur på mindre än 25 ºC är det en vätska och över den temperaturen är det en gas. I båda fallen är det extremt giftigt för människor, djur och till och med de flesta mikroorganismer som inte är vana vid det. Det är ett bra lösningsmedel för joner. Det är mycket instabilt eftersom det tenderar att polymerisera lätt.
Det finns i växtriket införlivat i molekylerna hos vissa glykosider, för när dessa hydrolyseras av enzymer från växten erhålls HCN, glukos och bensaldehyd..
Dessa glykosider finns i frön av vissa frukter som persikor, aprikoser, körsbär, plommon och i bittra mandlar, så de bör aldrig intas..
Det finns också i växtglykosider, såsom vissa typer av sorghum. Dessutom producerar vissa bakterier det under metabolismen. Det används främst vid framställning av polymerer och i vissa metallurgiska processer.
HCN är ett dödligt gift genom inandning, intag och kontakt. Det finns i cigarettrök och i rök från bränder av plast och material som innehåller kol och kväve. Det anses vara ett atmosfäriskt föroreningar eftersom det produceras under förbränning av organiskt material från stora områden på planeten.
Artikelindex
- 1 Molekylär struktur och elektronisk konfiguration
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Flampunkt
- 3.6 Självantändningstemperatur
- 3.7 Densitet
- 3.8 Löslighet
- 3.9 Dissociationskonstant
- 3.10 Vissa kemiska egenskaper
- 3.11 Korrosivitet
- 4 Plats i naturen
- 5 användningsområden
- 5.1 Vid framställning av andra kemiska föreningar och polymerer
- 5.2 Olika användningsområden
- 5.3 Inom jordbruket
- 6 risker
- 6.1 Mekanism för dödlig verkan i kroppen
- 6.2 Risk för cigarettrök
- 6.3 Risker för uppvärmning av HCN
- 6.4 Förekomst av HCN i brandrök
- 6.5 Luftföroreningar
- 7 Referenser
Molekylär struktur och elektronisk konfiguration
Hydrocyansyra eller cyanväte är en kovalent, molekylär förening med ett väte, ett kol och en kväveatom..
Kolatomen och kväveatomen delar 3 par elektroner, så de bildar en trippelbindning. Väte är bundet till kol, vilket med denna bindning uppvisar sin valens på fyra och dess kompletta elektronoktet.
Kväve har en valens på fem och för att slutföra sin oktett har den ett par oparade eller ensamma elektroner belägna i sidled.
HCN är därför en helt linjär molekyl med ett oparat par elektroner beläget i sidled i kvävet..
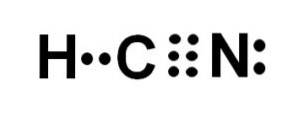
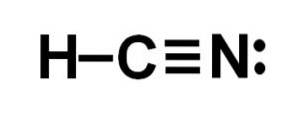
Nomenklatur
- Hydrocyansyra
- Vätecyanid
- Metanonitril
- Formonitril
- Hydrocyansyra
Egenskaper
Fysiskt tillstånd
Om den är vattenfri och stabiliserad under 25,6 ºC är den en färglös eller ljusblå vätska som är mycket instabil och giftig. Om det är över den temperaturen är det en extremt giftig färglös gas.
Molekylvikt
27,03 g / mol
Smältpunkt
-13,28 ºC
Kokpunkt
25,63 ºC (observera att det kokar strax över rumstemperatur).
Flampunkt
-18 ºC (sluten koppmetod)
Självantändningstemperatur
538 ºC
Densitet
0,6875 g / cm3 vid 20 ºC
Löslighet
Blandas helt med vatten, etylalkohol och etyleter.
Dissociationskonstant
K = 2,1 x 10-9
pKtill = 9,2 (det är en mycket svag syra)
Vissa kemiska egenskaper
HCN har en mycket hög dielektrisk konstant (107 till 25 ºC). Detta beror på att dess molekyler är mycket polära och associeras genom vätebindningar, som i fallet med vatten HtvåELLER.
På grund av sin höga dielektriska konstant visar sig HCN vara ett bra joniserande lösningsmedel..
Flytande vattenfri HCN är mycket instabil, den tenderar att polymerisera våldsamt. För att undvika detta tillsätts stabilisatorer, såsom en liten andel HtvåSW4.
I vattenlösning och i närvaro av ammoniak och högt tryck bildar det adenin, en förening som ingår i DNA och RNA, det vill säga en biologiskt viktig molekyl.
Det är en mycket svag syra, eftersom dess joniseringskonstant är mycket liten, så den joniseras bara delvis i vatten, vilket ger cyanidanjonen CN-. Bildar salter med baser men inte med karbonater.
Dess vattenhaltiga lösningar som inte skyddas från ljus sönderdelas långsamt och genererar ammoniumformiat HCOONH4.
I lösning har den en svag mandellukt.
Korrosivitet
Eftersom det är en svag syra är den i allmänhet inte frätande.
Vattenlösningar av HCN som innehåller svavelsyra som stabilisator angriper dock starkt stål vid temperaturer över 40 ° C och rostfritt stål vid temperaturer över 80 ° C..
Dessutom kan utspädda vattenhaltiga lösningar av HCN orsaka stress på kolstål även vid rumstemperatur..
Det kan också attackera vissa typer av gummi, plast och beläggningar.
Plats i naturen
Det finns relativt rikligt i växtriket som en del av glykosider.
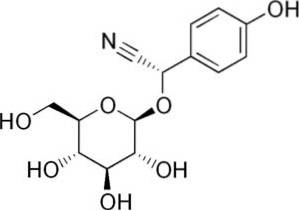
Till exempel genereras den från amygdalin C6H5-CH (-CN) -O-glukos-O-glukos, en förening närvarande i bittra mandlar. Amygdalin är en cyanogen beta-glukosid, eftersom den hydrolyseras bildar två glukosmolekyler, en av bensaldehyd och en av HCN. Enzymet som frigör dem är beta-glukoxidas.
Amygdalin finns i frön av persikor, aprikoser, bittra mandlar, körsbär och plommon..
Vissa typer av sorghumplanter innehåller den cyanogena glykosiden durrin (dvs p-hydroxi- (S) -mandelonitril-beta-D-glukosid). Denna förening kan brytas ned genom en enzymatisk hydrolys i två steg.
För det första hydrolyserar enzymet durrinas som är endogent i sorghumplanter till glukos och p-hydroxi- (S) -mandelonitril. Den senare omvandlas sedan snabbt till fri HCN och p-hydroxibensaldehyd.

HCN ansvarar för sorghumplanternas resistens mot skadedjur och patogener.
Detta förklaras av det faktum att durrin och enzymet durrinas har olika platser i dessa växter, och de kommer bara i kontakt när vävnaderna skadas eller förstörs, vilket frigör HCN och skyddar växten från infektioner som kan tränga igenom den skadade delen..
Dessutom har vissa humana patogena bakterier såsom Pseudomonas aeruginosa Y P. gingivalis de producerar det under sin metaboliska aktivitet.
Applikationer
Vid framställning av andra kemiska föreningar och polymerer
Användningen som involverar det mesta av HCN som produceras på industriell nivå är beredningen av mellanprodukter för organisk syntes..
Det används vid syntes av adiponitril NC- (CHtvå)4-CN, som används för att göra nylon, eller nylon, en polyamid. Det används också för att bereda akrylnitril eller cyanoetylen CHtvå= CH-CN, används för att bereda akrylfibrer och plast.
Dess derivat av natriumcyanid NaCN används för utvinning av guld vid utvinning av denna metall.
Ett annat av dess derivat, cyanogenkloriden ClCN, används för bekämpningsmedelsformler.
HCN används för framställning av kelatbildande medel såsom EDTA (etylen-diamin-tetraacetat).
Det används för tillverkning av ferrocyanider och vissa farmaceutiska produkter.
Olika användningsområden
HCN-gas har använts som insektsmedel, fungicid och desinfektionsmedel för rökning av fartyg och byggnader. Också att fumigera möbler för att återställa dem.
HCN har använts vid metallpolering, metallplätering, fotografiska processer och metallurgiska processer..
På grund av dess höga toxicitet utsågs det som ett kemiskt krigsmedel..
Inom jordbruket
Det har använts som en herbicid och bekämpningsmedel i fruktträdgårdar. Det användes för att kontrollera skalor och andra patogener på citrus träd, men några av dessa skadedjur har blivit resistenta mot HCN.
Det har också använts för att gasa kornsilor. HCN-gas framställd på plats har använts vid gasning av vetekorn för att bevara dem från skadedjur såsom insekter, svampar och gnagare. För denna användning är det viktigt att fröna som ska rökas tål bekämpningsmedlet..
Testning har gjorts genom att spruta vetefrön med HCN och det har visat sig att det inte påverkar deras grobarhetspotential negativt, snarare verkar det gynna det..
Höga doser av HCN kan dock avsevärt minska längden på de små bladen som gro från fröet..
Å andra sidan, på grund av det faktum att det är en kraftfull nematicid och att vissa sorghumväxter har det i sina vävnader, undersöks sorghumplantans potential att användas som biocid grön gödsel..
Dess användning skulle tjäna till att förbättra marken, undertrycka ogräs och kontrollera sjukdomar och skador orsakade av fytoparasitiska nematoder..
Risker
För människor är HCN ett dödligt gift på alla sätt: inandning, intag och kontakt..

Inandning kan vara dödlig. Det uppskattas att cirka 60-70% av befolkningen kan upptäcka HCNs bittera mandellukt när den är i luft i en koncentration av 1-5 ppm.
Men det finns 20% av befolkningen som inte kan upptäcka det ens vid dödliga koncentrationer eftersom de genetiskt inte kan göra det.
Förtäring är ett akut och omedelbart verkande gift..
Om deras lösningar kommer i kontakt med huden kan den associerade cyaniden vara dödlig.
HCN finns i cigarettrök och som alstras när kväve som innehåller kväve förbränns.
Dödlig verkningsmekanism i kroppen
Det är ett kemiskt kvävningsmedel och är snabbt giftigt och leder ofta till döden. När den kommer in i kroppen binder den till metalloenzymer (enzymer som innehåller en metalljon) och inaktiverar dem. Det är ett giftigt ämne för olika organ i människokroppen
Dess huvudsakliga toxiska effekt består i inhiberingen av cellulär andning, eftersom den inaktiverar ett enzym som påverkar fosforylering i mitokondrier, som är organeller som bland annat ingriper i cellens andningsfunktion..
Risk för cigarettrök
HCN finns i cigarettrök.
Även om många känner till förgiftningseffekten av HCN, är det få som inser att de utsätts för dess skadliga effekt genom cigarettrök..
HCN är en av orsakerna till inhiberingen av flera cellulära andningsenzymer. Mängden HCN i cigarettrök har en särskilt skadlig effekt på nervsystemet..
HCN-nivåer i cigarettrök har rapporterats mellan 10 och 400 μg per cigarett för direkt inandad rök och 0,006 till 0,27 μg / cigarett för sekundär inandning (begagnad rök). HCN producerar toxiska effekter från 40 μM och framåt.

Vid inandning kommer det snabbt in i blodomloppet, där det släpps ut i plasma eller binder till hemoglobin. En liten del omvandlas till tiocyanat och utsöndras i urinen.
Risker med HCN-uppvärmning
Långvarig exponering för värme av flytande HCN i slutna behållare kan orsaka oväntat våldsamt brott i behållarna. Kan polymerisera explosivt vid 50-60 ° C i närvaro av spår av alkali och i frånvaro av hämmare.
Förekomst av HCN i rök från bränder
HCN frigörs under förbränningen av kväveinnehållande polymerer, såsom ull, siden, polyakrylnitriler och nylon, bland andra. Dessa material finns i våra hem och på de flesta platser av mänsklig aktivitet.
Av denna anledning kan HCN potentiellt vara dödsorsaken vid inandning under bränder..
Atmosfärens förorening
HCN är en förorening av troposfären. Den är motståndskraftig mot fotolys och under de omgivande förhållandena i atmosfären genomgår den inte hydrolys.
Fotokemiskt producerade hydroxyl OH • radikaler kan reagera med HCN, men reaktionen är mycket långsam, så halveringstiden för HCN i atmosfären är 2 år.
När biomassa, särskilt torv, bränns, släpps HCN ut i atmosfären och även under industriell verksamhet. Förbränningen av torv är emellertid 5 till 10 gånger mer förorenande än förbränning av andra typer av biomassa.
Vissa forskare har funnit att de höga temperaturerna och torken orsakad av El Niño-fenomenet i vissa områden på planeten förvärrar säsongsbränder i områden med högt innehåll av sönderdelat växtmaterial..

Detta leder till intensiv biomassaförbränning under torra årstider..
Dessa händelser är källan till höga koncentrationer av HCN i troposfären, som så småningom transporteras till den nedre stratosfären och förblir mycket länge..
Referenser
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- USA National Library of Medicine. (2019). Vätecyanid. Återställd från pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Vätecyanid - en uppdatering. Yrkesmedicin 2017; 67: 662-663. Återställd från ncbi.nlm.nih.gov.
- Van Nostrand's Scientific Encyclopedia. (2005). Vätecyanid. 9th Återställd från onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (nitton nittiosex). Effekt av vätecyanid och karbonylsulfid på groning och vete av Vete. Pestic. Sci. 1996, 47, 1-5. Återställd från onlinelibrary.wiley.com.
- Från Nicola, G.R. et al. (2011). En enkel analytisk metod för utvärdering av dhurrininnehåll i cyanogena växter för deras användning i foder och biofumigation. J. Agric. Food Chem.2011, 59, 8065-8069. Återställd från pubs.acs.org.
- Sheese, P.E. et al. (2017). En global förbättring av vätecyanid i den nedre stratosfären under hela 2016. Geophys. Res. Lett., 44, 5791-5797. Återställd från agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. och Drochioiu, G. (2013). Visualisering av rökrisk: En enkel spektrofotometrisk bestämning av vätecyanid i cigarettrök och filter. J. Chem. Educ. 2013, 90, 1654-1657. Återställd från pubs.acs.org.
- Alarie, Y. et al. (1990). Vätecyanidens roll i mänskliga dödsfall i brand. I eld och polymerer. Kapitel 3. ACS Symposium Series. Återställd från pubs.acs.org.



Ingen har kommenterat den här artikeln än.