
Mangankloridegenskaper, struktur, användningsområden, risker

De manganklorid är ett oorganiskt salt vars kemiska formel är MnCltvå. Den består av Mn-jonertvå+ och Cl- i ett förhållande 1: 2; för varje Mn-katjontvå+ det finns dubbelt så många anjoner Cl-.
Detta salt kan bilda olika hydrater: MnCltvå2HtvåO, (dihydrat), MnCltvå4HtvåO (tetrahydrat) och MnCltvå6HtvåO (hexahydrat) Den vanligaste saltformen är tetrahydrat.

De fysikaliska egenskaperna hos manganklorid såsom densitet, smältpunkt och löslighet i vatten påverkas av dess hydratiseringsgrad. Exempelvis är smältpunkten för den vattenfria formen mycket högre än den för tetrahydratformen..
Färgen på manganklorid är ljusrosa (toppbild). Blekhet är karakteristisk för övergångsmetallsalter. Manganklorid är en svag Lewis-syra.
Mineralet känt som escacquita är den naturligt vattenfria formen av mangan (II) klorid; som kempita.
Mangan (II) klorid används som legeringsmedel; katalysator vid kloreringsreaktioner etc..
Artikelindex
- 1 Fysiska egenskaper
- 1.1 Fysiskt utseende
- 1.2 Molmassor
- 1.3 Smältpunkter
- 1.4 Kokpunkt
- 1.5 Densiteter
- 1.6 Löslighet i vatten
- 1.7 Löslighet i organiska lösningsmedel
- 1.8 Sönderdelning
- 1,9 pH
- 1.10 Stabilitet
- 2 Struktur av manganklorid
- 2.1 Dihydrat
- 2.2 Vattenfri
- 3 Nomenklatur
- 4 användningsområden
- 4.1 Laboratorium
- 4.2 Industri
- 4.3 Gödsel och djurfoder
- 5 risker
- 6 Referenser
Fysikaliska egenskaper
Fysiskt utseende
- Vattenfri form: rosa kubiska kristaller.
- Tetrahydratform: svagt delikat, rödaktiga monokliniska kristaller.
Molmassor
- Vattenfri: 125,838 g / mol.
- Dihydrat: 161,874 g / mol.
- Tetrahydrat: 197,91 g / mol.
Smältpunkter
- Vattenfri: 654 ºC.
- Dihydrat: 135 ºC.
- Tetrahydrat: 58 ºC.
Kokpunkt
Vattenfri form: 1.190 ºC.
Densiteter
- Vattenfri: 2 977 g / cm3.
- Dihydrat: 2,27 g / cm3.
- Tetrahydrat: 2,01 g / cm3.
Vattenlöslighet
Vattenfri form: 63,4 g / 100 ml vid 0 ° C; 73,9 g / 100 ml vid 20 ° C; 88,5 g / 100 ml vid 40 ° C; och 123,8 g / 100 ml vid 100 ° C.
Löslighet i organiska lösningsmedel
Löslig i pyridin och etanol, olöslig i eter.
Sönderfall
Såvida inte lämpliga försiktighetsåtgärder vidtas kan uttorkning av de hydratiserade formerna till den vattenfria formen leda till hydrolytisk dehydrering med produktion av väteklorid och manganoxiklorid..
pH
En 0,2 M lösning av mangankloridtetrahydrat i vattenlösning har ett pH på 5,5.
Stabilitet
Det är stabilt men känsligt för fukt och oförenligt med starka syror, reaktiva metaller och väteperoxid.
Struktur av manganklorid

Från och med det tetrahydrerade saltet, med slående rosa kristaller, måste det bestå av koordinationskomplex (toppbild). I dem, den metalliska mitten av Mntvå+ omges av en oktaeder definierad av fyra molekyler av HtvåO och två Cl-anjoner-.
Observera att Cl-liganderna- befinner sig i cis-positioner; alla är ekvivalenta i oktaedrons rektangulära bas, och det spelar ingen roll om Cl flyttas- till någon av de andra tre positionerna. En annan möjlig isomer för denna koordinatmolekyl är i vilken både Cl- befinner sig i transpositioner; det vill säga i olika ytterligheter (en ovan och den andra nedan).
De fyra vattenmolekylerna med sina vätebindningar gör att två eller flera oktaedrar kan förenas med dipol-dipolkrafter. Dessa broar är mycket riktade och lägger till de elektrostatiska interaktionerna mellan Mntvå+ och Cl-, upprätta en ordnad struktur som är karakteristisk för en kristall.
Den rosa färgen på MnCltvå4HtvåEller beror det på de elektroniska övergångarna till Mntvå+ och dess konfiguration d5. På samma sätt modifierar störningarna orsakade av närheten av vattenmolekyler och klorider mängden energi som krävs för att absorberas av sådana elektroner d5 för att resa högre energinivåer.
Dihydrat
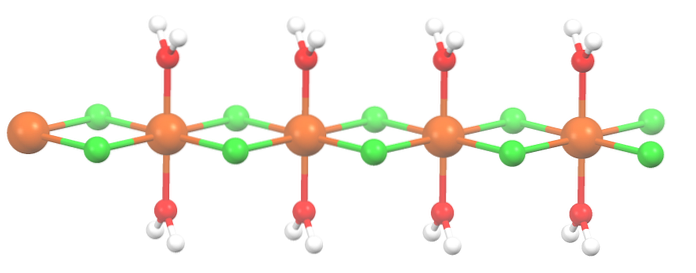
Saltet har torkats ut och dess formel är nu MnCltvå2HtvåO. Vad sägs om oktaedronen ovan? Ingenting, förutom att de två molekylerna av HtvåEller det som tappade ersätts med två Cl-.
Först kan du ge fel intryck av att det finns fyra Cl- för varje Mntvå+; emellertid är halvan av oktaedronen (axiellt) faktiskt kristallens upprepande enhet.
Således är det sant att det finns en Mntvå+ samordnas till två Cl- och två vattenmolekyler i transpositioner. Men för att den här enheten ska kunna interagera med en annan behöver den två Cl-broar, vilket i sin tur gör det möjligt att samordna oktaedron för mangan..
Förutom Cl-broar samarbetar också vattenmolekyler med sina vätebindningar så att denna MnCl-kedjatvå2HtvåEller avväpna inte.
Vattenfri
Slutligen har magnesiumkloriden tappat allt vattnet i dess kristaller. vi har nu det vattenfria saltet, MnCltvå. Utan vattenmolekylerna förlorar kristallerna märkbart intensiteten i sin rosa färg. Oktahedern, som för hydrater, förblir oförändrad av manganens natur.
Utan vattenmolekyler, Mntvå+ slutar omgiven av en oktaeder som endast består av Cl-. Denna koordinationsbindning har både kovalent och jonisk karaktär; av denna anledning hänvisar det vanligtvis till strukturen av MnCltvå som en polymer kristall. I det finns alternativa lager av Mn och Cl.
Nomenklatur
Mangan har många möjliga oxidationstillstånd. På grund av detta är den traditionella nomenklaturen för MnCltvå det klargörs inte.
Å andra sidan motsvarar manganklorid sitt bättre kända namn, till vilket det skulle vara nödvändigt att lägga till '(II)' för att få det att överensstämma med lagernomenklaturen: mangan (II) klorid. Och på samma sätt finns den systematiska nomenklaturen: mangandiklorid.
Applikationer
Laboratorium
Manganklorid fungerar som en katalysator för kloreringen av organiska föreningar.
Industri
Manganklorid används som råmaterial för tillverkning av antiklockor för bensin; svetsmaterial för icke-järnmetaller; mellanhand vid tillverkning av pigment; och linoljetork.
Den används i textilindustrin för tryckning och färgning; vid framställning av olika mangansalter, inklusive metylcyklopentadienylmangan-trikarbonyl, som används som tegelfärgmedel; och vid produktion av torra elektriska celler.
Manganklorid används som legeringsmedel och tillsätts till smält magnesium för att framställa mangan-magnesiumlegeringar; som mellanprodukt vid beredning av torkmedel för färg och lack; och som en del av desinfektionsmedel.
Det används också vid rening av magnesium.
Gödsel och djurfoder
Manganklorid används som källa till mangan, ett element som, även om det inte är ett primärt näringsämne för växter som kväve, fosfor och kalium, används i många biokemiska reaktioner som är typiska för dessa levande varelser..
På samma sätt läggs det till foder av avelsdjur för att leverera mangan, ett viktigt spårämne för djurens tillväxt..
Manganklorid är en kostkomponent som levererar mangan, ett element som är involverat i många processer som är nödvändiga för livet, inklusive: syntes av fettsyror och könshormoner; assimilering av vitamin E; broskproduktion; etc.
Risker
Det kan orsaka rodnad, irritation och dermatit vid hudkontakt. Manganklorid orsakar röda, ömma och vattna ögon.
Vid inandning orsakar salt hosta, ont i halsen och andfåddhet. Å andra sidan kan intag orsaka kräkningar, illamående och diarré..
Kronisk överdriven inandning av detta salt kan leda till lunginflammation och efterföljande reaktiv luftvägssjukdom..
Dess överdrivna intag kan orsaka psykiska störningar, uttorkning, hypotoni, lever- och njursvikt, svikt i multiorgansystemet och dödsfall..
Neurotoxicitet är den första manifestationen av den oönskade effekten av mangan och kan ge huvudvärk, yrsel, minnesförlust, hyperreflexi och mild tremor..
Allvarlig toxicitet manifesteras av symtom och tecken som liknar dem som ses vid Parkinsons sjukdom.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Mangan (II) klorid. Återställd från: en.wikipedia.org
- Sky Spring Nanomaterials. (2016). Mangankloridpulver. Återställd från: ssnano.com
- Kemikaliebok. (2017). Manganklorid. Återställd från: chemicalbook.com
- Toxicology Data Network. (s.f.). Manganklorid. Toxnet. Återställd från: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Mangan (II) klorid. doi.org/10.1002/047084289X.rm020
- Nationellt centrum för bioteknikinformation. (2019). Mangandiklorid. PubChem-databas. CID = 24480. Återställd från: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Mineraler: mangan. Återställd från: webconsultas.com


Ingen har kommenterat den här artikeln än.