
Järnklorid (FeCl2) struktur, användningsområden, egenskaper

De järnklorid är ett oorganiskt fast ämne bildat genom förening av en Fe-katjontvå+ och två kloridanjoner Cl-. Dess kemiska formel är FeCltvå. Det tenderar att absorbera vatten från miljön. Ett av dess hydrater är FeCl-tetrahydrattvå•4HtvåEller som är ett grönaktigt fast ämne.
Det bör noteras att det är mycket lösligt i vatten och tenderar att oxideras lätt i närvaro av luft och bildar järnklorid FeCl.3. Eftersom det är lätt att oxidera och därför kan fungera som ett reduktionsmedel används det i stor utsträckning i kemiska och biologiska forskningslaboratorier..

Järnklorid har flera användningsområden, varav det viktigaste är att hjälpa andra ämnen vid oxidation av slam från avloppsvatten eller avloppsrening. Det används också i järnbeläggningsprocessen för metaller och har vissa användningsområden inom läkemedelsindustrin..
Användningen av FeCl har också experimenteratstvå vid återvinning av värdefulla metaller från förbrukade katalysatorer som finns i avgasrören i fordon som körs med bensin eller diesel.
Den används i textilindustrin för att fixera färgerna i vissa typer av tyg.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Specifik vikt
- 3.6 Löslighet
- 3.7 Övriga egenskaper
- 4 Skaffa
- 5 användningsområden
- 5.1 Vid färgning av tyger
- 5.2 Vid avloppsrening
- 5.3 I kemiska studier
- 5.4 I biokemiska studier
- 6 Referenser
Strukturera
Järnklorid består av en järnjon Fetvå+ och två kloridjoner Cl- förenas med jonbindningar.
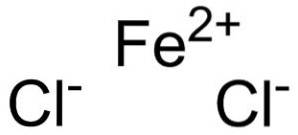
Järnjon Fetvå+ har följande elektroniska struktur:
1stvå, 2stvå 2 s6, 3stvå 3p6 3d6, 4s0
där det kan ses att han förlorade två elektroner från 4s skalet.
Denna konfiguration är inte särskilt stabil, och av den anledningen tenderar den att oxideras, det vill säga att förlora en annan elektron, den här gången från 3d-skiktet och bilda Fe-jonen.3+.
För sin del är kloridjonen Cl- har följande elektroniska struktur:
1stvå, 2stvå 2 s6, 3stvå 3p6
där du kan se att den förvärvade en extra elektron i 3p-skalet och slutförde den. Denna konfiguration är mycket stabil eftersom alla elektroniska lager är kompletta.
Nomenklatur
- Järnklorid
- Järn (II) klorid
- Järndiklorid
- Järnkloridtetrahydrat: FeCltvå•4HtvåELLER
Egenskaper
Fysiskt tillstånd
Färglösa till ljusgröna fasta kristaller.
Molekylvikt
126,75 g / mol
Smältpunkt
674 ºC
Kokpunkt
1023 ºC
Specifik vikt
3.16 vid 25 ºC / 4 ºC
Löslighet
Mycket löslig i vatten: 62,5 g / 100 ml vid 20 ºC. Löslig i alkohol, aceton. Lätt löslig i bensen. Praktiskt taget olöslig i eter.
Andra egenskaper
FeCltvå vattenfri är mycket hygroskopisk. Det absorberar lätt vatten från omgivningen och bildar en mängd olika hydrater, särskilt tetrahydratet, i vilket för varje FeCl-molekyltvå det finns 4 molekyler av HtvåEller kopplat till detta (FeCltvå•4HtvåELLER).
I närvaro av luft oxiderar den långsamt till FeCl3. Detta betyder att Fe-jonentvå+ lätt oxideras till Fe-jon3+.
Vid uppvärmning i närvaro av luft bildas snabbt järnklorid FeCl3 och järnoxid FetvåELLER3.
FeCltvå det är frätande för metaller och tyger.
Erhållande
Det erhålls genom att behandla ett överskott av järnmetall Fe med en vattenlösning av saltsyra-HCl vid höga temperaturer..
Tro0 + 2 HCl → FeCltvå + 2 timmar+
På grund av närvaron av vatten med denna metod erhålls emellertid järnkloridtetrahydrat FeCl.två•4HtvåELLER.
För att få det vattenfritt (utan att vatten inkorporeras i kristallerna) har vissa forskare valt att utföra reaktionen av järnpulver med vattenfri HCl (utan vatten) i lösningsmedlet tetrahydrofuran (THF) vid en temperatur av 5 ºC..
Föreningen FeCl erhålls på detta sätttvå•1,5 THF, som vid uppvärmning till 80-85 ° C under vakuum eller i kvävgasatmosfär (för att undvika närvaro av vatten) producerar FeCltvå vattenfri.
Applikationer
Järnklorid har olika användningsområden, vanligtvis baserat på dess reducerande kapacitet, det vill säga det kan lätt oxideras. Det används till exempel i färger och beläggningar, eftersom det hjälper till att fästa dem på ytan.
Järn är ett viktigt mikronäringsämne för människors och vissa djurs hälsa. Det är involverat i syntesen av proteiner, i andningen och i multiplikationen av celler.
Därav FeCltvå den används i farmaceutiska preparat. Fe-jonentvå+ som sådan absorberas den bättre än Fe-jonen3+ i tarmen.
Det används för tillverkning av FeCl3. Det används i metallurgi, i järnbeläggningsbad, för att ge en mer duktil avsättning.
Här är andra utvalda användningsområden.
Vid färgning av tyger
FeCltvå Det används som ett mordant eller färgämne fixeringsmedel i vissa typer av tyg. Mordanten reagerar kemiskt och binder samtidigt till färgämnet och tyget och bildar en olöslig förening på den..
På detta sätt förblir färgämnet fast vid tyget och dess färg intensifieras..
Vid avloppsrening
FeCltvå används i reningsverk eller avloppsreningsverk (avloppsvatten).
I denna ansökan deltar järnklorid i oxidationen av slammet genom en process som kallas Fentonoxidation. Denna oxidation orsakar nedbrytning av lera flockar och möjliggör utsläpp av vattnet som är starkt bundet till det..

Slammet kan sedan torkas och bortskaffas på ett miljövänligt sätt. Användningen av järnklorid hjälper till att sänka kostnaderna för processen.
Det har också nyligen föreslagits att använda det för att minska bildandet av vätesulfid eller vätesulfid i dessa avloppsvatten..
På detta sätt skulle korrosion som produceras av denna gas och även obehaglig lukt minskas..
I kemiska studier
På grund av dess reducerande egenskaper (motsatsen till oxidant), FeCltvå Det används ofta i olika undersökningar inom kemi-, fysik- och tekniklaboratorier.
Vissa forskare använde järnkloridångor för att extrahera värdefulla metaller som platina, palladium och rodium från förbrukade katalysatorer i bensin- eller dieseldrivna fordon..
Dessa katalysatorer används för att avlägsna gaser som är skadliga för människor och miljön. De finns i avgasröret på bilar och lastbilar som körs på bensin eller diesel.

Efter en viss tid slits fordonets katalysator ut och tappar sin effektivitet och måste bytas ut. Den använda katalysatorn kasseras och försök pågår för att återvinna de värdefulla metaller som den innehåller..

Enligt forskarna bildade dessa metaller magnetiska legeringar med järnet i järnklorid..
Legeringarna kunde extraheras med magneter och sedan återvinnas de värdefulla metallerna med välkända metoder..
I biokemiska studier
För att ha Fe-katjonentvå+, vilket är ett viktigt mikronäringsämne hos människor och vissa djur, FeCltvå används i biokemi och medicinstudier.
Vissa studier har visat att järnklorid förbättrar den svampdödande effekten av kall argonplasma..
Kall plasma är en teknik som används för sterilisering av medicinska ytor och instrument. Den är baserad på bildandet av hydroxylradikaler OH · från omgivningens fuktighet. Dessa radikaler reagerar med mikroorganismens cellvägg och orsakar dess död.
I denna utredning FeCltvå förbättrade effekten av kall plasma och påskyndade eliminering av en svamp som är resistent mot andra desinfektionsmetoder.
Vissa forskare fann att användningen av FeCltvå gör det möjligt att öka utbytet i reaktionerna för att erhålla glukos med utgångspunkt från sockerrör bagasse.
I det här fallet är Fetvå+ ett viktigt mikroelement för människors hälsa, dess närvaro i spår i produkten påverkar inte människor.
Referenser
- Fukuda, S. et al. (2019). Järnklorid och järnsulfat förbättrar den fungicidala effekten av kall atmosfärisk argonplasma på melaniserade Aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. Återställd från ncbi.clm.nih.gov.
- Ismal, O.E. och Yildirim, L. (2019). Metallmordants och biomordants. I The Impact and Prospects of Green Chemistry for Textile Technology. Kapitel 3, s. 57-82. Återställd från sciencedirect.com.
- Zhang, W. et al. (2019). Samkatalys av magnesiumklorid och järnklorid för xylo-oligosackarider och glukosproduktion från sockerrör bagasse. Bioresour Technol 2019, 291: 121839. Återställd från ncbi.nlm.nih.gov.
- Zhou, X. et al. (2015). Inhemskt järns roll för att förbättra slamavvattningsförmågan genom peroxidering. Vetenskapliga rapporter 5: 7516. Återställd från ncbi.nlm.nih.gov.
- Rathnayake, D. et al. (2019). Vätesulfidkontroll i avlopp genom att katalysera reaktionen med syre. Science of the Total Environment 689 (2019) 1192-1200. Återställd från ncbi.nlm.nih.gov.
- Taninouchi, Y. och Okabe, T.H. (2018). Återvinning av platinagruppsmetaller från förbrukade katalysatorer med hjälp av järnkloridångbehandling. Metall och Materi Trans B (2018) 49: 1781. Återställd från link.springer.com.
- USA National Library of Medicine. (2019). Järnklorid. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). Järn (0) Oxidation med klorväte i tetrahydrofuran: ett enkelt sätt att vattenfritt järn (II) klorid. Inorganic Chemistry, Vol. 16, nr 7, 1977. Återställd från pubs.acs.org.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.



Ingen har kommenterat den här artikeln än.