
Kromegenskaper, egenskaper och användningsområden

De krom (Cr) är ett metallelement i grupp 6 (VIB) i det periodiska systemet. Ton av denna metall produceras årligen genom extraktion från mineralet kromjärn eller magnesium (FeCrtvåELLER4, MgCrtvåELLER4), som reduceras med kol för att erhålla metallen. Det är mycket reaktivt, och endast under mycket reducerande förhållanden finns det i sin rena form.
Dess namn kommer från det grekiska ordet "chroma", vilket betyder färg. Det fick detta namn på grund av de många och intensiva färger som kromföreningar uppvisade, vare sig oorganiska eller organiska; från svarta fasta ämnen eller lösningar till gul, orange, grön, lila, blå och röd.

Färgen på metallkrom och dess karbider är dock silvergrå. Denna egenskap utnyttjas i förkromningstekniken för att ge många strukturer silverglitter (som de som ses i krokodilen i bilden ovan). Således, genom att "bada med krom" får bitarna lyster och ett stort motstånd mot korrosion..
Krom i lösning reagerar snabbt med syre i luften för att bilda oxider. Beroende på mediumets pH och oxidationsförhållanden kan det erhålla olika oxidationsnummer, dvs. (III) (Cr3+) den mest stabila av alla. Följaktligen krom (III) oxid (CrtvåELLER3) grön färg är den mest stabila av dess oxider.
Dessa oxider kan interagera med andra metaller i miljön och orsaka till exempel pigmentet Siberian red lead (PbCrO4). Detta pigment är gulorange eller rött (enligt dess alkalinitet), och från det isolerade den franska forskaren Louis Nicolas Vauquelin metallisk koppar, varför han tilldelas som dess upptäckare.
Dess mineraler och oxider, liksom en liten del av metallisk koppar gör att detta element upptar nummer 22 av de vanligaste i jordskorpan..
Kromkemi är mycket varierande eftersom den kan bilda bindningar med nästan hela det periodiska systemet. Var och en av dess föreningar uppvisar färger som beror på oxidationsnumret, liksom de arter som interagerar med det. På samma sätt bildar det bindningar med kol och ingriper i ett stort antal organometalliska föreningar..
[INNEHÅLL]
Egenskaper och egenskaper
Krom är en silvermetall i sin rena form, med ett atomnummer på 24 och en molekylvikt på cirka 52 g / mol (52Cr, dess mest stabila isotop).
Med tanke på dess starka metallbindningar har den höga smältpunkter (1907 ° C) och kokpunkter (2671 ° C). Dess kristallstruktur gör den också till en mycket tät metall (7,19 g / ml).
Det reagerar inte med vatten för att bilda hydroxider, men det reagerar med syror. Det oxiderar med syret i luften och genererar generellt kromoxid, som är ett allmänt använt grönt pigment..
Dessa oxidskikt skapar det som kallas passivering, skyddar metallen från efterföljande korrosion, eftersom syre inte kan tränga in i metall sinus.
Dess elektronkonfiguration är [Ar] 4s13d5, med alla elektroner oparade och uppvisar därför paramagnetiska egenskaper. Parningen av elektroniska snurr kan dock ske om metallen utsätts för låga temperaturer, vilket förvärvar andra egenskaper som antiferromagnetism.
Artikelindex
- 1 Egenskaper och egenskaper
- 2 Kromens kemiska struktur
- 3 oxidationsnummer
- 3,1 Cr (-2, -1 och 0)
- 3,2 Cr (I) och Cr (II)
- 3,3 Cr (III)
- 3,4 Cr (IV) och Cr (V)
- 3,5 Cr (VI): kromat-dikromatparet
- 4 Kromanvändning
- 4.1 Som färgämne eller pigment
- 4.2 I förkromning eller metallurgi
- 4.3 Näringsämnen
- 5 Var är?
- 6 Referenser
Krom kemisk struktur
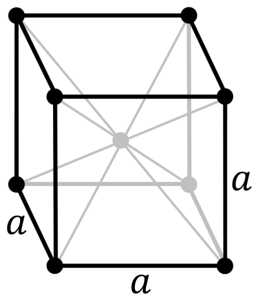
Vad är strukturen hos krommetall? I sin rena form antar krom en kroppscentrerad kubisk (cc eller bcc) kristallstruktur. Detta innebär att kromatomen är belägen i mitten av en kub, vars kanter är upptagna av andra krom (som i bilden ovan).
Denna struktur är ansvarig för krom med höga smält- och kokpunkter, liksom stor hårdhet. Kopparatomer överlappar sina s- och d-orbitaler för att bilda ledningsband enligt bandteorin.
Således är båda banden halvfulla. Varför? Eftersom dess elektronkonfiguration är [Ar] 4s13d5 och eftersom orbitalet kan hysa två elektroner, och d-orbitalerna tio. Då är bara hälften av de band som bildas av deras överlappningar ockuperade av elektroner..
Med dessa två perspektiv - den kristallina strukturen och metallbindningen - kan många av de fysiska egenskaperna hos denna metall förklaras i teorin. Ingen av dem förklarar dock varför krom kan ha olika oxidationstillstånd eller -tal..
Detta skulle kräva en djup förståelse av atomens stabilitet med avseende på elektroniska snurr..
Oxidationsnummer
Eftersom kromens elektronkonfiguration är [Ar] 4s13d5 kan få upp till en eller två elektroner (Cr1- och CRtvå-) eller förlora dem för att få olika oxidationsnummer.
Således, om krom tappar en elektron, skulle det förbli som [Ar] 4s03d5; om han tappar tre, [Ar] 4s03d3; och om det förlorar dem alla, [Ar], eller vad som är lika, skulle det vara isoelektroniskt att argonera.
Krom tappar inte eller får inte elektroner genom enbart infall: det måste finnas en art som donerar eller accepterar dem för att gå från ett oxidationsnummer till ett annat.
Krom har följande oxidationsnummer: -2, -1, 0, +1, +2, +3, +4, +5 och +6. Av dem +3, Cr3+, den är den mest stabila och därför dominerande av alla; följt av +6, Cr6+.
Cr (-2, -1 och 0)
Det är mycket osannolikt att krom får elektroner, eftersom det är en metall och därför är dess natur att donera dem. Det kan emellertid samordnas med ligander, det vill säga molekyler som interagerar med metallcentret genom en dativbindning..
En av de mest kända är kolmonoxid (CO), som bildar hexakarbonylföreningen av krom.
Denna förening har molekylformeln Cr (CO)6, och eftersom liganderna är neutrala och inte ger någon laddning, har Cr ett oxidationsnummer 0.
Detta kan också observeras i andra organometalliska föreningar såsom bis (bensen) krom. I den senare omges krom av två bensenringar i en molekylär struktur av sandwich-typ:
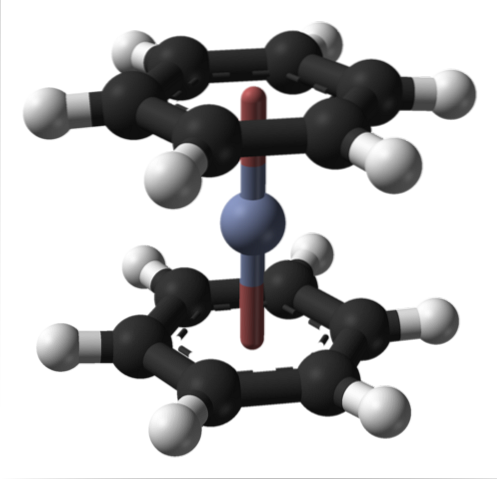
Från dessa två organometalliska föreningar kan många andra uppstå från Cr (0).
Salter har hittats där de interagerar med natriumkatjoner, vilket innebär att Cr måste ha ett negativt oxidationsnummer för att locka positiva laddningar: Cr (-2), Natvå[Cr (CO)5] och Cr (-1), Natvå[Crtvå(CO)10].
Cr (I) och Cr (II)
Cr (I) eller Cr1+ Det produceras genom oxidation av de organometalliska föreningarna som just beskrivits. Detta uppnås genom oxiderande ligander, såsom CN eller NO, och bildar sålunda exempelvis förening K3[Cr (CN)5INTE].
Här faktum att ha tre K-katjoner+ Det antyder att kromkomplexet har tre negativa laddningar; också liganden CN- bidrar med fem negativa laddningar, så att mellan Cr och NO måste lägga till två positiva laddningar (-5 + 2 = -3).
Om NO är neutralt är det Cr (II), men om det har en positiv laddning (NO+), är i så fall Cr (I).
Å andra sidan är Cr (II) -föreningar rikligare, inklusive följande: krom (II) klorid (CrCltvåkromacetat (Crtvå(ELLERtvåCCH3)4), krom (II) oxid (CrO), krom (II) sulfid (CrS) och mer.
Cr (III)
Av allt är det den som har störst stabilitet, eftersom den faktiskt är en produkt av många oxidativa reaktioner av kromatjoner. Kanske dess stabilitet beror på dess elektroniska konfiguration d3, där tre elektroner upptar tre d-orbitaler med lägre energi jämfört med de andra två mer energiska (delning av d-orbitaler).
Den mest representativa föreningen av detta oxidationsnummer är krom (III) oxid (CrtvåELLER3). Beroende på liganderna som samordnar den kommer komplexet att uppvisa en eller annan färg. Exempel på dessa föreningar är: [CrCltvå(HtvåELLER)4Cl, Cr (OH)3, CrF3, [Cr (HtvåELLER)6]3+, etc.
Även om den kemiska formeln inte visar det vid första anblicken har krom vanligtvis en oktaedrisk koordinationssfär i sina komplex; det vill säga den är belägen i mitten av en oktaeder där dess hörn placeras av liganderna (totalt sex).
Cr (IV) och Cr (V)
Föreningarna i vilka Cr deltar5+ är mycket få på grund av den elektroniska instabiliteten hos nämnda atom, förutom att de lätt oxideras till Cr6+, mycket mer stabilt eftersom det är isoelektroniskt jämfört med argon-ädelgas.
Emellertid kan Cr (V) -föreningar syntetiseras under vissa betingelser, såsom högt tryck. På samma sätt tenderar de att sönderdelas vid måttliga temperaturer, vilket gör deras möjliga applikationer omöjliga eftersom de inte har termiskt motstånd. Några av dem är: CrF5 och K3[Cr (Otvå)4] (Otvåtvå- är peroxidanjonen).
Å andra sidan har Cr4+ det är relativt mer stabilt och kan syntetisera halogenerade föreningar: CrF4, CrCl4 och CrBr4. De är emellertid också mottagliga för att sönderdelas av redoxreaktioner för att producera kromatomer med bättre oxidationsantal (såsom +3 eller +6)..
Cr (VI): kromat-dikromatparet
2 [CrO4]två- + 2H+ (Gul) => [CrtvåELLER7]två- + HtvåO (orange)
Ovanstående ekvation motsvarar syradimeriseringen av två kromatjoner för att producera dikromat. Variationen i pH orsakar en förändring i interaktionerna runt metallcentret för Cr6+, också tydligt i färg på lösningen (från gul till orange eller tvärtom). Dichromate består av en O-bro3Cr-O-CrO3.
Cr (VI) -föreningar har egenskaper som skadliga och till och med cancerframkallande för människokroppen och djuren.
Hur? Studier hävdar att CrO-joner4två- korsa cellmembran genom verkan av sulfattransporterande proteiner (båda jonerna är faktiskt lika i storlek).
Reduktionsmedel i celler reducerar Cr (VI) till Cr (III), som ackumuleras genom irreversibelt samordning till specifika platser på makromolekyler (såsom DNA).
Förorenade cellen med ett överskott av krom, den kan inte lämna på grund av bristen på mekanism som transporterar den tillbaka genom membranen.
Krom använder
Som färgämne eller pigment
Krom har ett brett utbud av applikationer, från färgämne för olika typer av tyger, till skydd som förskönar metalldelar i så kallad förkromning, som kan tillverkas med ren metall eller med Cr (III) föreningar eller Cr (VI).
Kromfluorid (CrF3) används till exempel som färgämne för ulltyger; kromsulfat (Crtvå(SW4)3), det används för att färga emaljer, keramik, färger, bläck, lack, och det används också för krommetaller; och kromoxid (CrtvåELLER3) finner också användning där dess attraktiva gröna färg krävs.
Därför kan alla krommineraler med intensiva färger vara avsedda att fläcka en struktur, men efter det uppstår faktum huruvida dessa föreningar är farliga eller inte för miljön eller för individens hälsa..
Faktum är att dess giftiga egenskaper används för att bevara trä och andra ytor från insektsattacker..
I krom eller metallurgi
Små mängder krom tillsätts också i stålet för att stärka det mot oxidation och förbättra dess glans. Detta beror på att den kan bilda gråkarbider (Cr3Ctvå) mycket resistent mot att reagera med syre i luften.
Eftersom krom kan poleras till blanka ytor har krom silverdesigner och färger som ett billigare alternativ för dessa ändamål..
Näringsämnen
Vissa diskuterar om krom kan betraktas som ett väsentligt element, det vill säga oumbärlig i den dagliga kosten. Det finns i vissa livsmedel i mycket små koncentrationer, såsom gröna blad och tomater..
På samma sätt finns det proteintillskott som reglerar insulinaktivitet och främjar muskeltillväxt, vilket är fallet med krompolynikotinat.
Var finns den?

Krom finns i en mängd olika mineraler och ädelstenar som rubiner och smaragder. Det viktigaste mineralet från vilket krom extraheras är krom (MCrtvåELLER4där M kan vara vilken annan metall som helst som kromoxid är associerad med. Dessa gruvor finns i överflöd i Sydafrika, Indien, Turkiet, Finland, Brasilien och andra länder.
Varje källa har en eller flera kromvarianter. På detta sätt uppstår för varje M (Fe, Mg, Mn, Zn, etc.) olika krommineraler.
För att extrahera metallen är det nödvändigt att reducera mineralet, det vill säga få krommetallcentret att få elektroner genom verkan av ett reduktionsmedel. Detta görs med kol eller aluminium:
FeCrtvåELLER4 + 4C => Fe + 2Cr + 4CO
Även krom (PbCrO4).
I allmänhet i vilket mineral som helst3+ kan ersätta Al3+, båda med något liknande jonradier, utgör en orenhet som resulterar i en annan naturlig källa till denna fantastiska men skadliga metall.
Referenser
- Tenenbaum E. Krom. Hämtad från: chemistry.pomona.edu
- Wikipedia. (2018). Krom. Hämtad från: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6 april 2018). Vad är skillnaden mellan krom och krom? Hämtad från: thoughtco.com
- N.V. Mandich. (nittonhundranittiofem). Kemi av krom. [PDF]. Hämtad från: citeseerx.ist.psu.edu
- Kemi LibreTexts. Kemi av krom. Hämtad från: chem.libretexts.org
- Saul 1. Shupack. (1991). Kemi av krom och några resulterande analytiska problem. Recenserad från: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Krom. Hämtad från: chemistryexplained.com


Ingen har kommenterat den här artikeln än.