
Erytropoiesis stadier och deras egenskaper, reglering, stimulanser
De erytropoies Det är den process genom vilken röda blodkroppar eller erytrocyter bildas. Dessa blodkroppar, hos människor, har en genomsnittlig livslängd på 4 månader och kan inte reproducera sig själva. På grund av detta måste nya erytrocyter skapas för att ersätta de som dör eller går förlorade i blödningar..
Hos män är antalet röda blodkroppar cirka 54 miljoner per milliliter, medan det hos kvinnor är något mindre (48 miljoner). Cirka 10 miljoner erytrocyter går förlorade dagligen, så en liknande mängd måste ersättas.
Erytrocyter bildas av kärnformade erytroblaster som finns i däggdjurets röda benmärg, medan de i andra ryggradsdjur produceras främst i njurarna och mjälten.
När de når slutet av sina dagar fragmenterar de; sedan omfattar celler som kallas makrofager dem. Dessa makrofager finns i levern, rött benmärg och mjälte..
När de röda blodkropparna förstörs återvinns järnet för att användas igen, medan resten av hemoglobinet omvandlas till ett gallpigment som kallas bilirubin..
Erytropoies stimuleras av ett hormon som kallas erytropoietin, men processen regleras av olika faktorer, såsom temperatur, syretryck, bland andra..
Artikelindex
- 1 Stadier och deras egenskaper
- 1.1 1-sprängande kolonibildande enheter
- 1.2 2-Erythroid-kolonibildande celler
- 1.3 3-proerythroblaster
- 1.4 4-basofila erytroblaster
- 1,5 5-polykromatofila erytroblaster
- 1,6 7-retikulocyter
- 1.7 8-erytrocyter
- 2 Reglering av erytropoies
- 2.1 Syretryck
- 2.2 Testosteron
- 2.3 Temperatur
- 2.4 Parakrinreglering
- 3 Erytropoies-stimulerande medel
- 3.1 Konstgjorda ESA
- 4 Ineffektiv erytropoies
- 4.1 Defekter i nukleinsyrasyntes
- 4.2 Defekter i syntesen av hemgruppen
- 4.3 Defekter i globinsyntes
- 5 Referenser
Stadier och deras egenskaper
I vuxna organismer förekommer erytropoies på specialiserade platser i den röda benmärgen som kallas erytroblastiska öar. För bildandet av erytrocyter måste flera processer inträffa, allt från cellproliferation till mognad av röda blodkroppar, som passerar genom olika stadier av celldifferentiering..
När celler genomgår mitotiska uppdelningar minskar deras storlek och deras kärna, liksom kromatinkondensation och hemoglobinisering. Dessutom flyttar de sig bort från ursprungsområdet.
I slutskedet kommer de att förlora kärnan och andra organeller och kommer att cirkulera och migrera genom de cytoplasmiska porerna i endotelcellerna..
Vissa författare delar upp hela erytropoesprocessen i två faser, den första av cellproliferation och differentiering; medan andra delar upp processen baserat på specifika egenskaper hos cellen i varje steg, när de observeras med Wrights fläck. Baserat på det senare är stadierna av erytropoies:
1-Burst-kolonibildande enheter
De är de första cellerna som är känsliga för erytropoietin, vissa författare kallar dem myeloida stamfäder, eller också BFU-E, för dess akronym på engelska. De kännetecknas av att uttrycka ytantigener såsom CD34, liksom av närvaron av erytropoietinreceptorer i små mängder.
2-Erythroid-kolonibildande celler
Förkortat på engelska som CFU-E, de kan producera små kolonier av erytroblaster. Ett annat kännetecken för dessa celler är att mängderna av erytropoietinreceptorer är mycket högre än i burst-kolonibildande enheter..
3-proerythroblaster
Betraktas som det första mognadsstadiet av erytrocyter. De kännetecknas av sin stora storlek (14 till 19 µm enligt vissa författare, upp till 25 µm enligt andra). Kärnan är rundad och presenterar också nukleoli och rikligt med kromatin.
Betraktas som det första mognadsstadiet av erytrocyter. De kännetecknas av sin stora storlek (14 till 19 µm enligt vissa författare, upp till 25 µm enligt andra). Kärnan är stor, rundad, med kromatin ordnat i form av trådar och 2 eller 3 nukleoler.
Plasmajärnupptagningen börjar i detta skede. De har en halveringstid på 20 timmar för att ge sig genom mitos till nästa steg.
4-basofila erytroblaster
Även kallade normoblaster, de är mindre än sina föregångare. Dessa celler fläckar blått med vital färgning, det vill säga de är basofila. Kärnan är kondenserad, kärnorna har försvunnit och de har ett stort antal ribosomer. I detta skede börjar syntesen av hemoglobin.
I början är de kända som typ I basofila erytroblaster och efter en mitotisk uppdelning förvandlas de till typ II, som förblir basofiler och ger större hemoglobinsyntes. Den ungefärliga varaktigheten för båda cellerna liknar den för proerythroblaster.
5-polykromatofila erytroblaster
De bildas genom mitotisk uppdelning av basofila erytroblaster av typ II och är de sista cellerna som kan divideras med mitos. Deras storlek varierar från 8 till 12 µm, och de har en rundad och kondenserad kärna.
Cytoplasman i dessa cellfläckar blir grå med Wrights fläck. Har en hög koncentration av hemoglobin och antalet ribosomer är fortfarande högt.
6-ortokromatiska erytroblaster
Färgen på dessa celler är rosa eller röd på grund av mängden hemoglobin de har. Dess storlek är något mindre än dess föregångare (7 till 10 µm) och den har en liten kärna som kommer att utvisas av exocytos när cellerna mognar..
7-retikulocyter
De bildas genom differentiering av ortokroma erytroblaster, förlorar organeller och fyller deras cytoplasma med hemoglobin. De förblir i den röda benmärgen i två till tre dagar tills de migrerar till blodet där de kommer att slutföra sin mognad..
8-erytrocyter
De är de mogna elementen, den slutliga produkten av erytropoies och som bildas genom mognad av retikulocyter. De har en bikoncav form på grund av frånvaron av en kärna och interaktionen mellan erytrocytens cytoskelet och två proteiner som kallas spektrin och aktin.
De är de vanligaste blodkropparna, de bildas av retikulocyter. Hos däggdjur har de en bikonkav form på grund av frånvaron av en kärna och interaktionen mellan erytrocytens cytoskelet och två proteiner som kallas spektrin och aktin. I andra ryggradsdjur är de rundade och behåller kärnan.
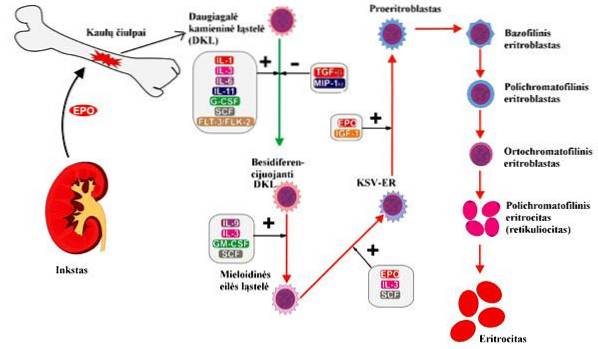
Reglering av erytropoies
Även om erytropoietin stimulerar bildandet av röda blodkroppar för att förbättra blodets syreförmåga, finns det flera grundläggande mekanismer för att reglera denna bildning, inklusive:
Syre tryck
Syrekoncentrationen i blodet reglerar erytropoies. När denna koncentration är mycket låg i blodflödet till njuren stimuleras produktionen av röda blodkroppar..
Denna låga koncentration av vävnad O2 kan uppstå på grund av hypoxemi, anemi, njurischemi eller när hemoglobins affinitet för denna gas är högre än normalt..
Miescher 1893 var den första som föreslog förhållandet mellan vävnadshypoxi och erytropoies. Men denna hypoxi stimulerar inte benmärgen direkt till att producera röda blodkroppar, som Miescher föreslog. Tvärtom, det inducerar njuren att producera hormonet erytropoietin.
Produktion av erytropoietin på grund av vävnadshypoxi regleras genetiskt och receptorerna som upptäcker sådan hypoxi finns i njurarna. Produktionen av erytropoietin ökar också på grund av en minskning av vävnadens syretryck efter blödning..
Cellerna som bildar erytropoietin finns i njuren och levern. Ökningen i produktionen av detta hormon under anemi beror på en ökning av antalet celler som producerar det..
Testosteron
Testosteron reglerar indirekt erytropoes genom att reglera järnnivåerna i blodet. Detta hormon verkar direkt på verkan av ett cytoplasmiskt protein som kallas BMP-Smad (benmorfogenetiskt protein-Smad) i hepatocyter..
På grund av testosteronets verkan undertrycks hepcidintranskription. Detta hepcidin förhindrar passage av järn från celler till plasma från makrofager som återvinner järn, vilket leder till en drastisk minskning av blodjärn.
När hypoferremi inträffar kommer erytropoietin att hämmas, eftersom det inte finns något järn för produktion av erytrocyter..
Temperatur
Temperatur har visat sig ha en effekt på erytripoies. Exponering för mycket låga temperaturer orsakar behovet av att producera värme i tygerna.
Detta kräver att antalet erytrocyter ökar för att tillföra syre till perifera vävnader. Det är dock inte helt klart hur denna typ av reglering sker..
Parakrinreglering
Tydligen finns det en produktion av erytropoietin av nervcellerna i centrala nervsystemet för att skydda sig mot ischemisk skada och apoptos. Men forskare har inte kunnat verifiera det ännu..
Erytropoes stimulerande medel
Erytropoiesstimulerande medel (ESA) är medel som är ansvariga för att stimulera produktionen av erytrocyter. Erytropoietin är det hormon som är naturligt ansvarigt för denna process, men det finns också syntetiska produkter med liknande egenskaper.
Erytropoietin är ett hormon som huvudsakligen syntetiseras i njuren. Under de tidiga utvecklingsstadierna är levern också inblandad i den aktiva produktionen av erytropoietin. Men när utvecklingen fortskrider har den senare kroppen mindre involvering i processen..
Erytrocyten börjar sprida receptorer för erytropoietin på membranytan. Erytropoietin aktiverar en serie intercellulära signaltransduktionskaskader som initialt producerar hemoglobinsyntes och får retikulocyter att agera snabbare och släppas ut i cirkulationen..
Konstgjorda ESA
Konstgjorda ESA klassificeras i generationer (första till tredje), beroende på datum då de skapades och marknadsfördes. Strukturellt och funktionellt lik erytropoietin.
Första generationens ESA är kända som epoetin alfa, beta och delta. De två första produceras genom rekombination från djurceller och har en halveringstid på cirka 8 timmar i kroppen. Epoetin delta syntetiseras under tiden från mänskliga celler.
Darbepoetin alfa är en andra generationens ESA, producerad av kinesiska hamsterceller med teknik som kallas rekombinant DNA. Den har en halveringstid mer än tre gånger längre än första generationens ESA. Som med epoetiner har vissa högpresterande idrottare använt darbepoetin som ett dopningsmedel.
Continuous Erythropoetin Receptor Activator, eller CERA för dess akronym på engelska, är det generiska namnet för tredje generationens ESA. De försöker inte simulera erytropoietins struktur och funktion utan verkar snarare genom att stimulera receptorn för erytropoietin, vilket ökar dess effekter..
Halveringstiden är flera veckor istället för timmar, som de tidigare drogerna. Används kommersiellt sedan 2008, men dess olagliga användning i sportaktiviteter går uppenbarligen tillbaka två eller tre år före dess lagliga kommersialisering.
Ineffektiv erytropoies
Ineffektiv eller ineffektiv erytropoies inträffar när de röda blodkropparna som bildas är defekta och vanligtvis förstörs före eller strax efter att benmärgen lämnat..
Ineffektiv erytropoies kan bero på defekter i syntesen av nukleinsyror, hemgruppen eller globinerna. Dessa defekter orsakar olika typer av anemi.
Defekter i nukleinsyrasyntes
I detta fall finns det en brist på folsyra och kobalamin, DNA-syntes hämmas i kärnan i erytrocytpromotorcellerna, så att de inte kan dela sig mitotiskt. Cytoplasman ökar för sin del sin volym (makrocytos), med ursprung i en stor cell som kallas megaloblast.
I dessa fall härrör en serie anemier som kallas megaloblastiska anemier, varav den vanligaste är perniciös anemi. I denna sjukdom finns det ingen absorption av vitamin B12 i tunntarmen.
Andra orsaker till megaloblastisk anemi inkluderar matsmältningssjukdomar, malabsorption, folsyrabrist och på grund av vissa mediciner.
Symtom på denna typ av anemi inkluderar onormal blekhet, irritabilitet, aptitlöshet, diarré, svårigheter att gå eller muskelsvaghet. Beroende på orsaken kan det behandlas med vitamin- eller folsyra-tillskott..
Defekter i syntesen av hemgruppen
Ineffektiv erytropoies på grund av brist i järnsyntes kan orsaka två typer av anemi; järnbrist mikrocytisk anemi och sideroblastisk anemi.
Mikrocytisk anemi är känd som en grupp anemier som kännetecknas av små och bleka röda blodkroppar, de kan ha olika ursprung, inklusive talassemi och ineffektiv erytropoies.
Järn- och hemosiderinnivåerna är mycket höga vid sideroblastisk anemi. Hemosiderin är ett gult pigment som härrör från hemoglobin och uppträder när nivåerna av metallen är högre än normalt. Denna typ av anemi orsakar basofils död i rött benmärg och det finns ingen syntes av hemoglobin.
Det kallas sideroblastisk anemi eftersom erytrocyter utvecklas onormalt på grund av ansamling av järn i form av granuler och får namnet sideroblaster. Sideroblastisk anemi kan vara medfödd eller kan vara sekundär och ha olika orsaker.
Defekter i globinsyntes
I det här fallet uppträder sigdcellanemi och beta-talassemi. Seglcellanemi är också känd som sigdcellanemi. Den produceras genom en genetisk mutation som leder till att valin substitueras med glutaminsyra under syntesen av beta-globin.
På grund av detta substitution minskar affiniteten hos syre av hemoglobin och det förekommer atrofi hos erytrocyten, vilket får en segdform i stället för den normala bikonkava skivformen. Patienten med sigdcellanemi är känslig för mikroinfarkt och hemolys.
Talassemia är en sjukdom som orsakas av en otillräcklig genetisk kodning av α- och β-globiner som leder till en tidig död av erytrocyten. Det finns cirka hundra olika mutationer som kan orsaka talassemi med olika svårighetsgrad.
Referenser
- Eritropoies. På Wikipedia. Återställd från en.wikipedia.org.
- J.P. Labbrozzi (2015). Produktion av erytrocyter från CD34-celler+ navelsträngsblod. Doktorsavhandling. Autonoma universitetet i Barcelona. Spanien.
- H. Parrales (2018). Fysiologi av erytropoies. Återställd från cerebromedico.com.
- Anemi. På Wikipedia. Återställd från en.wikipedia.org.
- Erithropoiesis stimulerande medel. På Wikipedia. Återställd från en.wikipedia.org.
- Ineffektiv eritropoies. På Wikipedia. Återställd från en.wikipedia.org.



Ingen har kommenterat den här artikeln än.