
Mikroskopiska skalegenskaper, räknar partiklar, exempel
De mikroskopisk skala Det är en som används för att mäta storlekar och längder som inte kan ses med blotta ögat och som är under en millimeter långa. Från högsta till lägsta är de mikroskopiska skalorna i det metriska systemet:
- Millimeter (1 mm), som är en tiondel av en centimeter eller en tusendel av en meter. I detta är skalan vi har en av de största cellerna i kroppen, vilket är ägget, vars storlek är 1,5 mm.
- En tiondel av en millimeter (0,1 mm). Detta är skalan på tjockleken eller diametern på ett människohår.
- Mikrometern eller mikronen (1 μm = 0,001 mm). På denna skala finns växt- och djurceller och bakterier.
Växtceller är i storleksordningen 100 μm. Djurceller är tio gånger mindre, det är i storleksordningen 10μm; medan bakterier är tio gånger mindre än djurceller och är i storleksordningen 1μm.
Artikelindex
- 1 Nanoskala
- 2 Instrument för mikroskopisk observation
- 3 mikroskopiska egenskaper
- 3.1-Matter är ett enormt tomrum
- 4 Hur man räknar partiklar i mikroskopisk skala?
- 4.1-Exempel 1
- 4.2 -Exempel 2
- 5 Referenser
Nano skala
Det finns mätningar som är ännu mindre än den mikroskopiska skalan, men de används inte vanligtvis utom i vissa speciella sammanhang. Här är några av de viktigaste nanometriska mätningarna:
- Nanometern (1 ηm = 0,001 μm = 0,000001 mm) är en miljonedel av en millimeter. På denna skala finns några virus och molekyler. Virus är i storleksordningen 10ηm och molekyler i storleksordningen 1ηm.
- Ångströmmen (1Å = 0,1ηm = 0,0001μm = 10-7mm). Denna mätning bildar skalan eller atomstorleken.
- Fantomometern (1fm = 0,00001Å = 0,000001ηm = 10-12mm). Detta är skalan för atomkärnor, som är mellan 10 000 och 100 000 gånger mindre än atomen. Men trots sin lilla storlek koncentrerar kärnan 99,99% av atommassan.
- Det finns mindre skalor i atomkärnan, eftersom dessa består av partiklar som protoner och neutroner. Men det finns mer: dessa partiklar består i sin tur av mer grundläggande partiklar som kvarker..
Instrument för mikroskopisk observation
När föremål ligger mellan millimeter- och mikrometerskalorna (1 mm - 0,001 mm) kan de observeras med ett optiskt mikroskop.
Men om föremålen eller strukturerna ligger mellan nanometer och ångström, kommer elektronmikroskop eller nanoskopet att krävas..
I elektronmikroskopi används istället för ljus högenergielektroner som har en mycket kortare våglängd än ljus. Nackdelen med elektronmikroskopet är att det inte är möjligt att placera levande prover i det eftersom det fungerar under vakuum..
Istället använder nanoskopet laserljus, och det har fördelen jämfört med elektronmikroskopi att strukturerna och molekylerna i en levande cell kan ses och registreras..
Nanoteknik är den teknik med vilken kretsar, strukturer, delar och till och med motorer tillverkas på skalor som går från nanometern till atomskalan..
Mikroskopiska egenskaper
I fysik studeras materiens och systemens beteende i en första approximation ur makroskopisk synvinkel. Från detta paradigm är materia ett oändligt delbart kontinuum; och denna synvinkel är giltig och lämplig för många situationer i vardagen.
Men vissa fenomen i den makroskopiska världen kan bara förklaras om materiens mikroskopiska egenskaper beaktas..
I mikroskopisk synvinkel beaktas materiens molekylära och atomstruktur. Till skillnad från det makroskopiska tillvägagångssättet finns det i denna skala en granulär struktur med luckor och mellanrum mellan molekyler, atomer och till och med inom dem..
Det andra kännetecknet ur mikroskopisk synvinkel i fysik är att en bit materia, oavsett hur liten, består av ett enormt antal partiklar separerade från varandra och i kontinuerlig rörelse..
-Materie är ett enormt tomrum
I en liten bit materia är avståndet mellan atomer enormt jämfört med deras storlek, men i sin tur är atomerna enorma jämfört med sina egna kärnor, där 99,99% av massan är koncentrerad..
Det vill säga en materia i mikroskopisk skala är ett enormt vakuum med koncentrationer av atomer och kärnor som upptar en liten del av den totala volymen. I denna mening liknar den mikroskopiska skalan den astronomiska skalan..
Från makroskopiska objekt till upptäckten av atomen
De första kemisterna, som var alkemisterna, insåg att materialen kunde vara av två typer: rena eller sammansatta. Således kom tanken på kemiska grundämnen fram.
De första kemiska elementen som upptäcktes var de sju metallerna från antiken: silver, guld, järn, bly, tenn, koppar och kvicksilver. Med tiden upptäcktes mer i den utsträckning att ämnen hittades som inte kunde sönderdelas i andra.
Sedan klassificerades grundämnena efter deras egenskaper och egenskaper i metaller och icke-metaller. Alla de som hade liknande egenskaper och kemisk affinitet grupperades i samma kolumn och därmed uppstod elementens periodiska system..
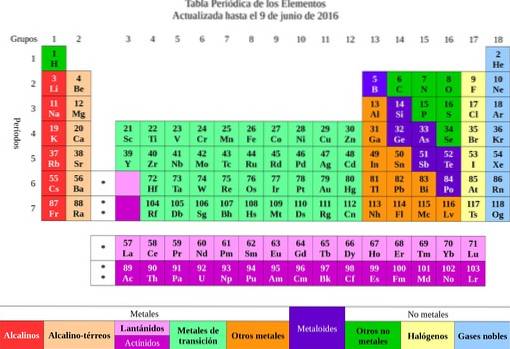
Från elementen fördes idén om atomer, ett ord som betyder odelbar. En kort tid senare insåg forskare att atomer hade en struktur. Dessutom hade atomerna två typer av elektrisk laddning (positiv och negativ).
Subatomära partiklar
I Rutherfords experiment där han bombade atomerna på en tunn guldplatta med alfapartiklar avslöjades atomens struktur: en liten positiv kärna omgiven av elektroner.
Atomer fortsatte att bombas med mer och mer energipartiklar och görs fortfarande för att avslöja hemligheterna och egenskaperna hos den mikroskopiska världen i mindre och mindre skala..
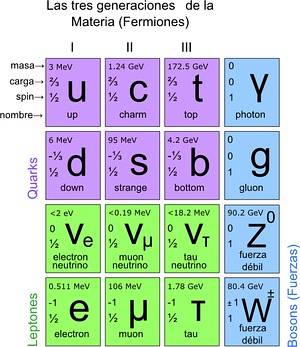
På detta sätt nåddes standardmodellen, där det fastställs att de sanna elementära partiklarna är de som atomer består av. I sin tur ger atomer upphov till element, dessa till föreningar och alla kända interaktioner (utom gravitation). Totalt finns det 12 partiklar.
Dessa grundläggande partiklar har också sitt periodiska system. Det finns två grupper: de ½-spin-fermioniska partiklarna och de bosoniska. Bosonerna är ansvariga för interaktionerna. Fermionikerna är 12 och är de som ger upphov till protoner, neutroner och atomer.
Hur man räknar partiklar i mikroskopisk skala?
Med tiden upptäckte kemister de relativa massorna av elementen från exakta mätningar i kemiska reaktioner. Således kan man till exempel bestämma att kol är 12 gånger tyngre än väte..
Väte bestämdes också vara det lättaste elementet, så detta element tilldelades den relativa massan 1.
Å andra sidan krävde kemister att veta antalet partiklar som är involverade i en reaktion, så att inget reagens är över eller saknas. Till exempel kräver en vattenmolekyl två väteatomer och en syreatomer..
Från dessa föregångare föddes begreppet mol. En mol av vilken substans som helst är ett fast antal partiklar som motsvarar dess molekyl- eller atommassa i gram. Således bestämdes att 12 gram kol har samma antal partiklar som 1 gram väte. Det numret är känt som Avogadros nummer: 6,02 x 10 ^ 23 partiklar.
-Exempel 1
Beräkna hur många guldatomer som finns i 1 gram guld.
Lösning
Guld är känt för att ha en atomvikt på 197. Dessa data finns i det periodiska systemet och indikerar att en guldatom är 197 gånger tyngre än en av väte och 197/12 = 16,416 gånger tyngre än kol..
En mol guld har 6,02 × 10 ^ 23 atomer och har atomvikten uttryckt i gram, det vill säga 197 gram.
I ett gram guld finns 1/197 mol guld, det vill säga 6,02 × 10 ^ 23 atomer / 197 = 3,06 x10 ^ 23 guldatomer.
-Exempel 2
Bestäm antalet molekyler kalciumkarbonat (CaCO3) som finns i 150 gram av detta ämne. Berätta också hur många kalciumatomer, hur många kol och hur många syre som finns i denna förening.
Lösning
Det första är att bestämma kalciumkarbonatets molekylvikt. Det periodiska systemet indikerar att kalcium har en molekylvikt på 40 g / mol, kol 12 g / mol och syre 16 g / mol..
Sedan molekylmassan av (CaCO3) kommer vara :
40 g / mol + 12 g / mol + 3 x 16 g / mol = 100 g / mol
Var 100 gram kalciumkarbonat är 1 mol. Så i 150 gram motsvarar de 1,5 mol.
Varje mol karbonat har 6,02 x 10 ^ 23 karbonatmolekyler, så i 1,5 mol karbonat finns det 9,03 x 10 ^ 23 molekyler.
Kort sagt, i 150 gram kalciumkarbonat finns det:
- 9,03 x 10 ^ 23 molekyler av kalciumkarbonat.
- Kalciumatomer: 9,03 x 10 ^ 23 .
- Också 9,03 x 10 ^ 23 kolatomer
- Slutligen 3 x 9,03 x 10 ^ 23 syreatomer = 27,09 x 10 ^ 23 syreatomer.
Referenser
- Tillämpad biologi. Vilka är de mikroskopiska mätningarna? Återställd från: youtube.com
- Kemisk utbildning. Makroskopiska, submikroskopiska och symboliska framställningar om materia. Återställd från: scielo.org.mx.
- García A. Interaktiv fysikskurs. Makrotillstånd, mikrostatus. Temperatur, entropi. Återställd från: sc.ehu.es
- Materiens mikroskopiska struktur. Återställd från: alipso.com
- Wikipedia. Mikroskopisk nivå. Återställd från: wikipedia.com



Ingen har kommenterat den här artikeln än.