
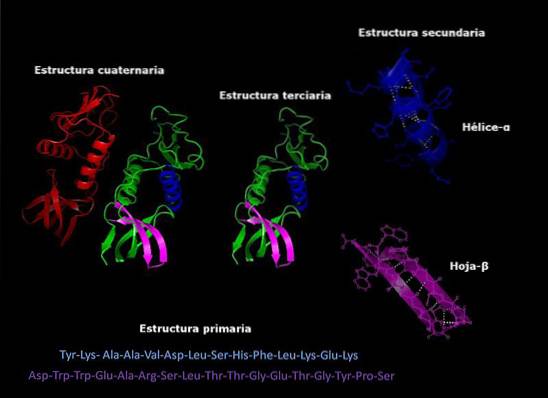
Primär struktur för karakteristiska proteiner
De primär struktur av proteiner Det är ordningen i vilken aminosyrorna i polypeptiden eller polypeptiderna som innefattar dem är ordnade. Ett protein är en biopolymer som består av a-aminosyramonomerer kopplade genom peptidbindningar. Varje protein har en definierad sekvens av dessa aminosyror.
Proteiner utför en mängd olika biologiska funktioner, inklusive att forma och upprätthålla cellernas integritet genom cytoskelettet, försvara kroppen från främmande medel genom antikroppar och katalysera kemiska reaktioner i kroppen genom enzymer..
Idag är det snabbare att bestämma proteinkompositionen och ordningen i vilken aminosyror ordnas (sekvensering) än för flera år sedan. Denna information deponeras i internationella elektroniska databaser, som kan nås via internet (bland annat GenBank, PIR).
Artikelindex
- 1 Aminosyror
- 1.1 Alifatiska aminosyror
- 1.2 Aminosyror med sidokedjor innehållande hydroxyl eller svavel
- 1.3 Cykliska aminosyror
- 1.4 Aromatiska aminosyror
- 1.5 Basiska aminosyror
- 1.6 Sura aminosyror och deras amider
- 2 Peptidbindningar
- 3 Aminosyrasekvens
- 4 Kodning av proteiner
- 5 Referenser
Aminosyror
Aminosyror är molekyler som innehåller en aminogrupp och en karboxylsyra-grupp. När det gäller a-aminosyror har de en central kolatom (a-kol) till vilken både aminogruppen och karboxylgruppen är bunden, liksom en väteatom och en distinkt R-grupp, som kallas sidokedja.
På grund av denna konfiguration av a-kolet är aminosyrorna som bildas, kända som a-aminosyror, kirala. Två former produceras som är spegelbilder av varandra och kallas L- och D-enantiomerer..
Alla proteiner i levande varelser består av 20 a-aminosyror med L-konfiguration. Sidokedjorna för dessa 20 aminosyror är olika och har en stor mångfald av kemiska grupper.
I grund och botten kan a-aminosyror grupperas (godtyckligt) beroende på typen av sidokedja enligt följande.
Alifatiska aminosyror
I denna grupp finns enligt vissa författare Glycin (Gli), Alanin (Ala), Valine (Val), Leucine (Leu) och Isoleucine (Ile). Andra författare inkluderar också metionin (Met) och Proline (Pro).
Aminosyror med hydroxyl- eller svavelinnehållande sidokedjor
Innehåller Serine (Ser), Cystein (Cys), Treonin (Thr) och även metionin. Enligt vissa författare bör gruppen endast inkludera Ser och Thr.
Cykliska aminosyror
Består enbart av Proline, som, som redan nämnts, ingår av andra författare bland de alifatiska aminosyrorna.
Aromatiska aminosyror
Fenylalanin (Phe), tyrosin (Tyr) och tryptofan (Trp).
Basiska aminosyror
Histidin (His), Lysin (Lys) och Arginin (Arg)
Sura aminosyror och deras amider
Den innehåller asparaginsyror (Asp) och glutaminsyror (Glu) samt amiderna Aspargine (Asn) och Glutamine (Gln). Vissa författare delar upp den sista gruppen i två; å ena sidan av sura aminosyror (de två första) och å andra sidan de som innehåller karboxylamid (de återstående två).
Peptidbindningar
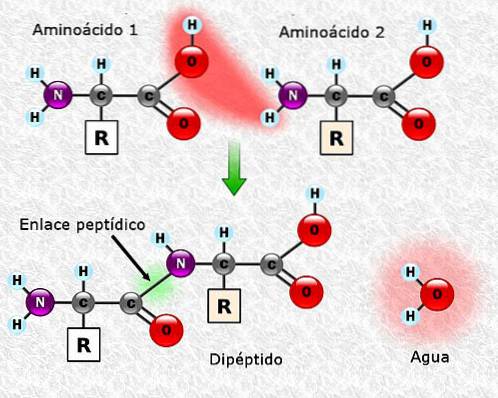
Aminosyror kan kopplas ihop med hjälp av peptidbindningar. Dessa bindningar, även kallade amidbindningar, upprättas mellan a-aminogruppen i en aminosyra och a-karboxylgruppen i en annan. Denna union bildas med förlusten av en vattenmolekyl.
Föreningen mellan två aminosyror resulterar i bildandet av en dipeptid, och om nya aminosyror tillsätts kan tripeptider, tetrapeptider och så vidare bildas sekventiellt.
Polypeptider som består av ett litet antal aminosyror kallas vanligtvis oligopeptider, och om antalet aminosyror är högt så kallas de polypeptider..
Varje aminosyra som tillsätts till polypeptidkedjan frigör en molekyl vatten. Den del av aminosyran som har förlorat H + eller OH- under förening kallas aminosyraresten.
De flesta av dessa oligopeptid- och polypeptidkedjor har i ena änden en aminoterminal grupp (N-terminal) och i den andra en terminal karboxyl (C-terminal). Dessutom kan de innehålla många joniserbara grupper mellan aminosyraresterna som utgör dem. På grund av detta anses de vara polyampoliter.
Aminosyrasekvens
Varje protein har en viss sekvens av sina aminosyrarester. Denna ordning är det som kallas proteinets primära struktur..
Varje enskilt protein i varje organism är artsspecifikt. Det vill säga att en människas myoglobin är identisk med en människas, men det har små skillnader med andra däggdjurs myoglobiner..
Mängden och typerna av aminosyror som ett protein innehåller är lika viktig som placeringen av dessa aminosyror i polypeptidkedjan. För att förstå proteiner måste biokemister först isolera och rena varje enskilt protein, sedan analysera aminosyrahalten och slutligen bestämma dess sekvens..
För att isolera och rena proteiner finns det olika metoder, bland annat: centrifugering, kromatografi, gelfiltrering, dialys och ultrafiltrering, samt användningen av proteinets löslighetsegenskaper..
Bestämningen av aminosyrorna som finns i proteiner utförs enligt tre steg. Den första är att bryta peptidbindningar genom hydrolys. Därefter separeras de olika typerna av aminosyror i blandningen; och slutligen kvantifieras var och en av de erhållna typerna av aminosyror.
För att bestämma proteinets primära struktur kan olika metoder användas; men för närvarande är den mest använda Edman-metoden, som i grunden består av att markera och separera den N-terminala aminosyran från resten av kedjan upprepade gånger, och identifiera varje aminosyra som frigörs individuellt.
Proteinkodning
Proteinernas primära struktur är kodad i organismernas gener. Genetisk information finns i DNA, men för dess översättning till proteiner måste den först transkriberas till mRNA-molekyler. Varje nukleotidtriplett (kodon) kodar för en aminosyra.
Eftersom det finns 64 möjliga kodoner och endast 20 aminosyror används vid konstruktionen av proteiner kan varje aminosyra kodas av mer än ett kodon. Praktiskt taget alla levande saker använder samma kodoner för att koda för samma aminosyror. Därför anses den genetiska koden vara ett nästan universellt språk.
I denna kod finns kodoner som används för att starta och också stoppa translationen av polypeptiden. Stoppkodonerna kodar inte för någon aminosyra utan stoppar translation vid kedjans C-terminal och representeras av tripletterna UAA, UAG och UGA..
Å andra sidan fungerar AUG-kodonet normalt som en startsignal och kodar också för metionin..
Efter translation kan proteiner genomgå viss bearbetning eller modifiering, såsom förkortning genom fragmentering, för att uppnå sin slutliga konfiguration.
Referenser
- C.K. Mathews, K.E. van Holde & K.G. Ahern. 2002. Biokemi. 3th utgåva. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. 1996. Harper's Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (nd). Biokemi. 5th utgåva. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. tvånd utgåva. Thieme.
- A. Lehninger (1978). Biokemi. Ediciones Omega, S.A.
- L. Stryer (1995). Biokemi. W.H. Freeman and Company, New York.



Ingen har kommenterat den här artikeln än.