
Etylenglykolegenskaper, kemisk struktur, användningsområden
De etylenglykol det är den enklaste organiska föreningen i glykolfamiljen. Dess kemiska formel är CtvåH6ELLERtvå, medan dess strukturformel är HOCHtvå-CHtvåÅH. En glykol är en alkohol som kännetecknas av att ha två hydroxylgrupper (OH) bundna till två angränsande kolatomer i en alifatisk kedja.
Etylenglykol är en klar, färglös och luktfri vätska. På bilden nedan har du ett prov av honom i en burk. Dessutom har den en söt smak och är mycket hygroskopisk. Det är en lätt flyktig vätska, så den utövar ett mycket litet ångtryck, med ångdensiteten större än luftens densitet..

Etylenglykol är en förening med stor löslighet i vatten, förutom att den är blandbar med många organiska föreningar; såsom kortkedjiga alifatiska alkoholer, aceton, glycerol, etc. Detta beror på deras förmåga att donera och acceptera vätebindningar från protiska lösningsmedel (som har H).
Etylenglykol polymeriserar till många föreningar, vars namn ofta förkortas till PEG och ett tal som anger deras ungefärliga molekylvikt. PEG 400 är till exempel en relativt liten flytande polymer. Medan stora PEG är vita fasta ämnen med ett fett utseende.
Etylenglykolens egenskap för att sänka smältpunkten och öka vattenets kokpunkt, tillåter användning som kylvätska och antikoagulant i fordon, flygplan och datorutrustning.
Artikelindex
- 1 Fastigheter
- 1.1 Namn
- 1.2 Molmassa
- 1.3 Fysiskt utseende
- 1.4 Lukt
- 1.5 Smak
- 1.6 Densitet
- 1.7 Smältpunkt
- 1.8 Kokpunkt
- 1.9 Löslighet i vatten
- 1.10 Löslighet i andra lösningsmedel
- 1.11 Flampunkt
- 1.12 Ångdensitet
- 1.13 Ångtryck
- 1.14 Sönderdelning
- 1.15 Lagringstemperatur
- 1.16 Förbränningsvärme
- 1.17 Förångningsvärme
- 1.18 Ytspänning
- 1.19 Brytningsindex
- 1.20 Dissociationskonstant
- 1,21 pH
- 1.22 Fördelningskoefficient oktanol / vatten
- 2 Kemisk struktur
- 3 Produktion
- 3.1 Oxidation av eten
- 3.2 Hydrolys av etylenoxid
- 3.3 Omega-processen
- 4 användningsområden
- 4.1 Kylvätska och frostskyddsmedel
- 4.2 Dehydrering
- 4.3 Tillverkning av polymerer
- 4.4 Explosiva ämnen
- 4.5 Träskydd
- 4.6 Andra applikationer
- 5 Förgiftning och risker
- 5.1 Symtom från exponering
- 5.2 Förtäringskador
- 5.3 Ekologiska konsekvenser av etylenglykol
- 6 Referenser
Egenskaper
Namn
Etan-1,2-diol (IUPAC), etylenglykol, monoetylenglykol (MEG), 1-2-dihydroxietan.
Molmassa
62,068 g / mol
Fysiskt utseende
Klar, färglös och viskös vätska.
Odör
Toalett
Smak
Godis
Densitet
1,1132 g / cm3
Smältpunkt
-12,9 ºC
Kokpunkt
197,3 ºC
Vattenlöslighet
Blandbar med vatten, mycket hygroskopisk förening.
Löslighet i andra lösningsmedel
Blandbar med lägre alifatiska alkoholer (metanol och etanol), glycerol, ättiksyra, aceton och liknande ketoner, aldehyder, pyridin, koltjärbaser och lösliga i eter. Praktiskt taget olöslig i bensen och dess homologer, klorerade kolväten, petroleumeter och oljor.
antändningspunkt
111 ºC
Ång-densitet
2.14 i förhållande till luft tagen som 1.
Ångtryck
0,092 mmHg vid 25 ° C (genom extrapolering).
Sönderfall
Vid uppvärmning till nedbrytning avger den sur och irriterande rök.
Förvaringstemperatur
2-8 ºC
Förbränningsvärme
1,189,2 kJ / mol
Förångningsvärme
50,5 kJ / mol
Ytspänning
47,99 mN / m vid 25 ºC
Brytningsindex
1,4318 vid 20 ºC
Dissociationskonstant
pKa = 14,22 vid 25 ° C
pH
6 till 7,5 (100 g / l vatten) vid 20 ºC
Fördelningskoefficient oktanol / vatten
Logg P = - 1,69
Kemisk struktur
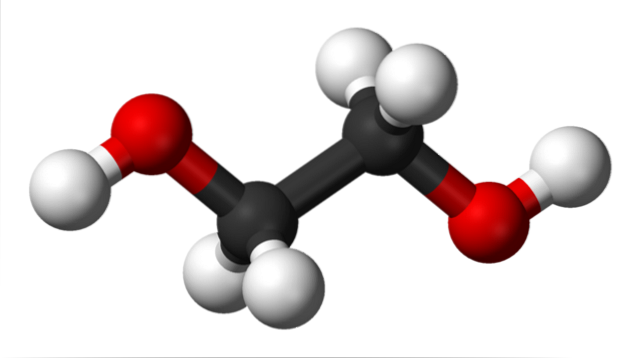
I den övre bilden har vi etylenglykolmolekylen representerad av en modell av sfärer och staplar. De svarta sfärerna motsvarar kolatomerna, som utgör deras C-C-skelett, och i deras ändar har vi de röda och vita sfärerna för syre- respektive väteatomerna..
Det är en symmetrisk molekyl och vid första anblicken kan man tro att den har ett permanent dipolmoment; deras C-OH-bindningar roterar emellertid, vilket gynnar dipolen. Det är också en dynamisk molekyl, som genomgår konstanta rotationer och vibrationer, och som kan bilda eller ta emot vätebindningar tack vare dess två OH-grupper..
Faktum är att dessa interaktioner är ansvariga för etylenglykol med så hög kokpunkt (197 ºC).
När temperaturen sjunker till -13 ° C sammanfaller molekylerna i en ortorhombisk kristall, där rotamerer spelar en viktig roll. det vill säga det finns molekyler som har sina O-H-grupper orienterade i olika riktningar.
Produktion
Etylenoxidation
Det första steget i syntesen av etylenglykol är oxidationen av eten till etylenoxid. Tidigare reagerades etylen med hypoklorsyra för att producera klorhydrin. Detta behandlades sedan med kalciumhydroxid för att producera etylenoxid..
Klorohydrinmetoden är inte särskilt lönsam och en metod för direkt oxidation av eten i närvaro av luft eller syre byttes till med silveroxid som katalysator..
Etylenoxidhydrolys
Hydrolys av etylenoxid (EO) med vatten under tryck ger en rå blandning. Vatten-glykolblandningen indunstas och återvinns, och separerar monoetylenglykol från dietylenglykol och trietylenglykol genom fraktionerad destillation..
Etylenoxidhydrolysreaktionen kan beskrivas enligt följande:
CtvåH4O + HtvåO => OH-CHtvå-CHtvå-OH (etylenglykol eller monoetylenglykol)
Mitsubishi Chemical utvecklade en katalytisk process genom användning av fosfor i omvandlingen av etylenoxid till monoetylenglykol.
Omega-processen
I Omega-processen omvandlas ursprungligen etylenoxid till etylenkarbonat genom dess reaktion med koldioxid (COtvå). Därefter underkastas etylenkarbonatet en katalytisk hydrolys för erhållande av monoetylenglykolen med 98% selektivitet.
Det finns en relativt ny metod för syntes av etylenglykol. Detta består av oxidativ karbonylering av metanol till dimetyloxalat (DMO) och dess efterföljande hydrering till etylenglykol..
Applikationer
Kylvätska och frostskyddsmedel
Blandningen av etylenglykol med vatten möjliggör en minskning av fryspunkten och en ökning av kokpunkten, vilket gör att bilmotorer inte fryser på vintern eller överhettas på sommaren.
När procentandelen etylenglykol i blandningen med vatten når 70% är fryspunkten -55 ºC, så etylenglykol-vattenblandningen kan användas som kylvätska och skydd mot frysning under de förhållanden under vilka det kan förekomma.
De låga frysningstemperaturerna för etylenglykollösningar möjliggör dess användning som frostskyddsmedel i bilmotorer; avisning av flygplanets vingar; och vid avisning av vindrutorna.
Den används också för att bevara biologiska prover som bevaras vid låga temperaturer, vilket undviker bildandet av kristaller som kan skada provernas struktur..
Den höga kokpunkten gör att etylenglykollösningar kan användas för att hålla låga temperaturer i enheter eller utrustning som genererar värme vid användning, såsom: bilar, datorutrustning, luftkonditioneringsapparater etc..
Uttorkning
Etylenglykol är en mycket hygroskopisk förening som har gjort det möjligt att behandla gaser som extraherats från undergrunden och som har ett högt innehåll av vattenångor. Eliminering av vatten från naturgaser gynnar deras effektiva användning i deras respektive industriella processer..
Polymertillverkning
Etylenglykol används för syntes av polymerer, såsom polyetylenglykol (PEG), polyetylentereftalat (PET) och polyuretan. PEG är en familj av polymerer som används i applikationer såsom: matförtjockning, förstoppning, kosmetika etc..
PET används vid tillverkning av alla typer av engångsbehållare, som används i olika typer av drycker och livsmedel. Polyuretan används som värmeisolator i kylskåp och som fyllmedel i olika typer av möbler.
Explosiva varor
Det används vid tillverkning av dynamit, så att genom att minska nitroglycerins fryspunkt kan det lagras med mindre risk..
Träskydd
Etylenglykol används vid behandling av trä för att skydda det mot dess ruttna, framställt genom svampverkan. Detta är viktigt för att bevara museets konstverk.
Andra appar
Etylenglykol finns i media för att suspendera ledande salter i elektrolytkondensatorer och i sojaskumstabilisatorer. Det används också vid tillverkning av mjukgörare, elastomerer och syntetiska växer.
Etylenglykol används vid separering av aromatiska och paraffiniska kolväten. Dessutom används den vid tillverkning av tvättmedel för rengöringsutrustning. Ökar viskositeten och minskar bläckets flyktighet, vilket gör det lättare att använda.
Etylenglykol kan också användas i gjuteriet av formningssand och som smörjmedel under slipning av glas och cement. Det används också som en ingrediens i hydrauliska bromsvätskor och som mellanprodukt vid syntes av estrar, etrar, polyesterfibrer och hartser..
Bland hartserna i vilka etylenglykol används som råmaterial är alkyden, som används som bas för alkydfärger, applicerad i bil- och arkitektoniska färger..
Förgiftning och risker
Symtom från exponering
Etylenglykol har låg akut toxicitet när det verkar vid hudkontakt eller om det inhaleras. Men dess toxicitet manifesteras fullständigt vid intag, indikeras som den dödliga dosen etylenglykol på 1,5 g / kg kroppsvikt, eller 100 ml för en 70 kg vuxen..
Akut exponering för etylenglykol ger följande symtom: inandning orsakar hosta, yrsel och huvudvärk. På huden uppstår torrhet vid kontakt med etylenglykol. Under tiden producerar det rodnad och smärta i ögonen.
Förtärningsskador
Förtäring av etylenglykol manifesteras av buksmärta, illamående, medvetslöshet och kräkningar. Ett överdrivet intag av etylenglykol har en skadlig effekt på centrala nervsystemet (CNS), kardiovaskulär funktion och njurmorfologi och fysiologi..
På grund av fel i CNS-funktionen uppstår förlamning eller oregelbunden ögonrörelse (nystagmus). I det kardiopulmonala systemet finns högt blodtryck, takykardi och möjlig hjärtsvikt. Det finns allvarliga förändringar i njuren, produkt av förgiftning med etylenglykol.
Utspädning, degeneration och kalciumoxalatavsättning sker i njurarna. Det senare förklaras av följande mekanism: etylenglykol metaboliseras av mjölkdehydrogenasenzymet för att producera glykaldehyd.
Glykoaldehyd ger upphov till glykolsyra, glyoxylsyra och oxalsyra. Oxalsyra fälls snabbt ut med kalcium för att bilda kalciumoxalat, vars olösliga kristaller deponeras i njurarna, vilket ger morfologiska förändringar och dysfunktion i dem, vilket kan leda till njursvikt..
På grund av toxiciteten hos etylenglykol har den i vissa av dess tillämpningar gradvis ersatts med propylenglykol.
Ekologiska konsekvenser av etylenglykol
Under deras avisning frigör flygplan betydande mängder etylenglykol, som slutar ackumuleras på landningsremsorna, som när de tvättas får vattnet att överföra etylenglykol genom avloppssystemet till floderna där dess toxicitet påverkar flygplanet. fisk.
Men toxiciteten hos etylenglykol är inte i sig den främsta orsaken till ekologisk skada. Under dess aeroba biologiska nedbrytning konsumeras en betydande mängd syre, vilket orsakar dess minskning av ytvattnet.
Å andra sidan kan dess anaeroba biologiska nedbrytning frigöra giftiga ämnen för fisk, såsom acetaldehyd, etanol, acetat och metan..
Referenser
- Wikipedia. (2019). Etylenglykol. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. PubChem-databas. (2019). 1,2-etandiol. CID = 174. Återställd från: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Etylenglykol: struktur, formel och användningar. Studie. Återställd från: study.com
- Leroy G. Wade. (27 november 2018). Etylenglykol. Encyclopædia Britannica. Återställd från: britannica.com
- A. Dominic Fortes & Emmanuelle Suard. (2011). Kristallstrukturer av etylenglykol och etylenglykolmonohydrat. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 december 2010). Etylenglykol (EG) tillverknings- och tillverkningsprocess. Återställd från: icis.com
- Lucy Bell Young. (2019). Vad är användningen av etylenglykol? Reagens. Återställd från: chemicals.co.uk
- QuimiNet. (2019). Ursprung, typer och tillämpningar av etylenglykoler. Återställd från: quiminet.com
- R. Gomes, R. Liteplo och M.E. Ödmjuk. (2002). Etylenglykol: Människors hälsoaspekter. Världshälsoorganisationen Genève. [PDF]. Återställd från: who.int


Ingen har kommenterat den här artikeln än.