
Natriumcitrat (C6H5O7Na3) struktur, användningsområden, egenskaper
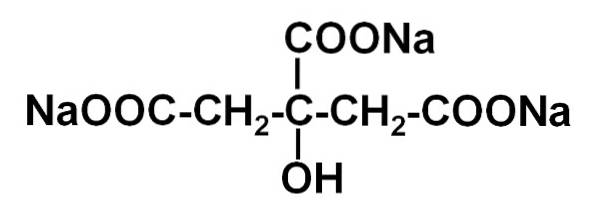
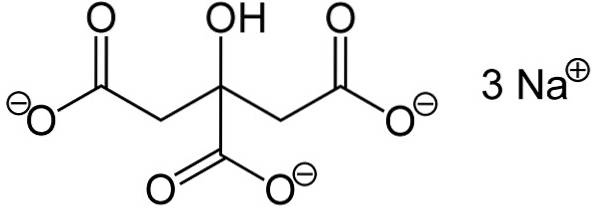
De natriumcitrat Det är natriumsaltet av citronsyra. Den bildas av en citratanjon C6H5ELLER73- och tre natrium-Na-katjoner+. Dess molekylformel är C6H5ELLER7Na3 eller i dess expanderade form: NaOOC-CHtvå-C (COONa) (OH) -CHtvå-COONa. Natriumcitrat är den konjugerade basen av citronsyra, det vill säga den erhålles teoretiskt från den senare genom att ersätta varje H-proton+ av -COOH för en natrium-Na+.
Den kan framställas i vattenfri form (utan vatten i sin sammansättning) eller i dess hydratiserade form med 2 eller 5 molekyler vatten. Det är en förening som när vattenfri (utan vatten) tenderar att absorbera vatten från miljön.
Natriumcitrat fungerar som en buffert, vilket innebär att det stabiliserar pH, vilket är ett mått på surheten eller basiteten hos en vattenlösning. Den har också egenskapen att bilda en stabil förening med kalcium-Ca-joner.två+, kalciumcitrat.
Det används till exempel i livsmedelsindustrin för att förhindra att komjölk bildar klumpar som är svåra för spädbarn att smälta.
I bioanalyslaboratorier används det för att förhindra att blodet dras från patienter för att vissa test koagulerar. Det förhindrar också att blod som används i transfusioner koagulerar. Det används ofta i fosfatfria rengöringsmedel eftersom det inte är förorenande.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Löslighet
- 3,5 pH
- 3.6 Kemiska egenskaper
- 3.7 Övriga egenskaper
- 4 Skaffa
- 4.1 Plats i naturen
- 5 användningsområden
- 5.1 I livsmedelsindustrin
- 5.2 I medicin
- 5.3 Inom läkemedelsindustrin
- 5.4 I blodprover
- 5.5 I syntesen av nanopartiklar
- 5.6 I miljövänliga rengöringsmedel
- 5.7 För att förbättra utnyttjandet av tjärsand
- 5.8 I andra applikationer
- 6 Referenser
Strukturera
Trinatriumcitrat består av tre natriumnajoner+ och en citratjon.
Citratjonen består av en kedja med tre kolatomer till vilka 3 karboxylater är bundna -COO- (en för varje kolatom) och en hydroxyl-OH vid det centrala kolet.
Var och en av de 3 Na-jonerna+ är knuten till en -COO-grupp-.
Nomenklatur
- Natriumcitrat
- Trinatriumcitrat
- Trinatrium-2-hydroxipropan-1,2,3-trikarboxylat
Egenskaper
Fysiskt tillstånd
Vit eller färglös kristallin fast substans.
Molekylvikt
258,07 g / mol
Smältpunkt
300 ºC
Löslighet
Det är mycket lösligt i vatten: 42,5 g / 100 ml vid 25 ºC. Det är praktiskt taget olösligt i alkohol.
pH
En 5-procentig vattenlösning av natriumcitrat har ett pH mellan 7,5 och 9,0, det vill säga den är lätt alkalisk.
Kemiska egenskaper
Natriumcitrat är en buffert, vilket innebär att det stabiliserar pH, vilket är ett mått på surhetsgraden eller alkaliniteten i en vattenlösning. Citrat, genom att stabilisera pH, tillåter inte lösningen att sura eller alkalisera över vissa värden.
När det finns överflödiga protoner H+ tar dem att konvertera sina -COO-grupper- i -COOH-grupper. Omvänt, om det finns många OH-grupper- ger upp protonerna i deras -COOH-grupper och omvandlar dem till -COO-.
När den transformeras av kroppen ger den 3 molekyler HCO3- för varje citratmolekyl.
Andra egenskaper
Dess kristaller är smakfulla, det vill säga de absorberar vatten från luften. Natriumcitratdihydrat är mer stabil i luften.
Om dihydratet värms upp blir det vattenfritt (utan vatten) när det når 150 ° C.
Liksom citronsyra smakar natriumcitrat surt.
Erhållande
Natriumcitrat framställs vanligtvis genom att tillsätta natriumkarbonat till en citronsyralösning tills brus upphör. Brusningen beror på utvecklingen av koldioxid COtvå:
NatvåCO3 + Citronsyra → Natriumcitrat + COtvå↑
Därefter indunstas vattnet från lösningen för att kristallisera produkten.
Det kan också framställas genom behandling av en natriumsulfatlösning med kalciumcitrat:
NatvåSW4 + Kalciumcitrat → Natriumcitrat + CaSO4↓
Lösningen filtreras för att avlägsna CaSO4 fast som har fällt ut. Därefter koncentreras lösningen och så kristalliseras natriumcitratet.
Plats i naturen
Natriumcitrat är den konjugerade basen av citronsyra, som är en naturlig förening som finns i alla levande organismer eftersom den är en del av deras ämnesomsättning, vilket är mekanismen för att utveckla energi i celler..
Applikationer
I livsmedelsindustrin
Natriumcitrat har olika användningar inom livsmedelsindustrin, till exempel som surhetsreglerande, sekvestrerande, stabiliserande, ytaktivt medel eller emulgeringsmedel..
Den används bland annat i drycker, frysta desserter och specialostar.
Det gör det möjligt att undvika koagulering av mjölk, så det tillsätts till komjölk som används för utfodring av ammande barn. På detta sätt skapas inte blodproppar eller hårda ostmassor som är svåra att smälta av barnens mage..

Det används för att påskynda färgfixeringen i härdat fläsk eller nötkött, det vill säga kött som har behandlats för att förhindra förstörelse. Upp till 50% askorbinsyra ersätts i dessa.

Det används också för att förhindra blodproppar i färskt nötkött (såsom biffar).
Inom medicin
Det används som ett alkaliserande medel, eftersom det neutraliserar överskott av syra i blodet och urinen. Det är indicerat för att behandla metabolisk acidos som uppstår när kroppen producerar för mycket syra.
Efter intag blir citratjonen bikarbonatjon som är ett systemiskt alkaliserande medel (det vill säga av hela organismen) och som en följd neutraliseras H-jonerna.+, ökar blodets pH och vänder eller eliminerar acidos.
Natriumcitrat fungerar som ett neutraliserande medel för magbesvär.
Det används som en slemlösande och sudorific. Det har diuretisk verkan. Ökar urinutsöndringen av kalcium i urinen, varför det används vid hyperkalcemi, det vill säga när det finns ett överskott av kalcium i blodet.
Det tjänar också till att underlätta borttagning av bly när blyförgiftning inträffar..
Om det administreras i överskott kan det orsaka alkalos, muskelspasmer på grund av funktionsstörning i bisköldkörteln och depression av hjärtfunktionen på grund av en minskning av kalciumnivån i blodet, bland andra symtom..
Natriumcitrat används vid transfusioner. Det tillsätts blodet tillsammans med dextros för att förhindra att det koagulerar.
Normalt metaboliserar levern snabbt citratet som erhålls vid transfusionen, men under transfusioner av stora mängder kan leverns kapacitet överskridas..
I sådana fall, eftersom citrat bildar ett komplex med kalcium, resulterar en minskning av kalciumjonen Ca.två+ i blodet. Detta kan leda till yrsel, skakningar, stickningar etc. Därför måste transfusioner utföras långsamt.
Inom läkemedelsindustrin
Bland många andra användningsområden används den för att förhindra att läkemedel där det finns järn och tanniner blir mörkare.
I blodprov
Det används som ett antikoagulerande medel vid bloduppsamling eller när det måste förvaras, eftersom det fungerar som en kelator för kalcium-Ca-joner.två+, det vill säga det binder till kalciumjoner som bildar kalciumcitrat som inte är joniserat.
Det används i koagulationstester och vid bestämning av sedimentationshastigheten för röda blodkroppar..
Det används som ett antikoagulant under plasmaferes, ett förfarande för att avlägsna överskott av ämnen som är skadliga för kroppen från blodet..
I syntesen av nanopartiklar
Det används som en stabilisator vid syntesen av guldnanopartiklar. Trinatriumcitratdihydrat tillsätts till kloroaurinsyra och bildar en vinröd suspension..
Natriumcitrat fungerar som ett reduktionsmedel och som ett blodplättmedel, eftersom det adsorberas på nanopartiklarna..
På grund av den negativa laddningen av citrat stöter partiklarna från varandra och undviker agglomerering och bildar en stabil dispersion. Ju högre citratkoncentration, desto mindre blir partiklarna..
Dessa nanopartiklar används för att förbereda medicinska biosensorer.
I miljövänliga rengöringsmedel
Natriumcitrat används ofta i fosfatfria flytande rengöringsmedel. Detta beror på att dess miljöbeteende är ofarligt eftersom det är en metabolit som finns i alla levande organismer..
Det är lätt biologiskt nedbrytbart och svagt giftigt för vattenlevande organismer. Av denna anledning anses det vara ett rengöringsmedel med ekologiskt gynnsamma egenskaper..
För att förbättra utnyttjandet av tjärsand
Oljesand är sandformationer som är rika på bitumen eller tjära, ett material som liknar petroleum.
Natriumcitrat har framgångsrikt testats i kombination med natriumhydroxid NaOH för att extrahera olja från tjärsand.
Man tror att genom att förena citratet med sandstenen, -COO-jonerna- Citrat bildar ett stort antal negativa laddningar på kiseldioxidpartiklar. Detta ger en bättre separering av sanden från bitumen genom enkel avstötning av grusens negativa laddningar från bitumenets negativa laddningar..
I andra applikationer
Den används vid fotografering, för att avlägsna spårmetaller, vid galvanisering och för att ta bort SOtvå avgaser.
Referenser
- USA National Library of Medicine. (2019). Natriumcitrat. Återställd från: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Insamling och hantering av blod. I Dacie och Lewis Praktisk hematologi (tolfte upplagan). Återställd från sciencedirect.com.
- Steber, J. (2007). Ekotoxiciteten hos ingredienser för rengöringsprodukter. I handbok för rengöring / sanering av ytor. Återställd från sciencedirect.com.
- Xiang, B. et al. (2019). Studie av natriumcitratets roll vid frigöring av bitumen. Energidrivmedel 2019, 33, 8271-8278. Återställd från pubs.acs.org.
- Heddle, N. och Webert, K.E. (2007). Transfusionsmedicin. In Blood Banking and Transfusion Medicine (andra upplagan). Återställd från sciencedirect.com.
- Sudhakar, S. och Santhosh, P.B. (2017). Guld nanomaterial. I framsteg inom biomembran och självmontering av lipider. Återställd från sciencedirect.com.
- Elsevier (ledare) (2018). Kapitel 8. Nanometal. I grundläggande och tillämpningar av nanokisel i plasma och fulleriner. Nuvarande och framtida trender Micro och Nano Technologies. Sidorna 169-203. Återställd från sciencedirect.com.



Ingen har kommenterat den här artikeln än.