
Kaliumferrocyanids egenskaper, risker och användningar
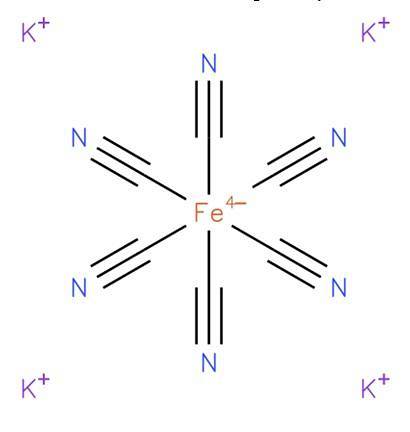
De kaliumferrocyanid, även känd som kaliumhexacyanoferrat (II) eller preussisk gul, är det en oorganisk förening med formeln K4[Faith (CN)6]. Det är ett kaliumsalt av ferrocyanidkoordinationskomplexet (Fe (CN))64-och är i allmänhet i trihydratform K4[Faith (CN)6] · HtvåO. Dess struktur visas i figur 1 (EMBL-EBI, 2008).
Historiskt var den tillverkad av organiskt koldioxidkällor, järnspån och kaliumkarbonat. Vanliga källor till kväve och kol var skrotläder, slaktbiprodukter eller torkat blod.
För närvarande produceras kaliumferrocyanid industriellt från vätecyanid, järnklorid och kalciumhydroxid, vars kombination ger Catvå [Faith (CN) 6] · 11HtvåELLER.
Denna lösning behandlas sedan med kaliumsalter för att fälla ut det blandade kalcium-kalium-CaK-saltet.två [Faith (CN) 6], som i sin tur behandlas med kaliumkarbonat för att ge tetrakaliumsaltet.
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 Reaktivitet och faror
- 2.1 Ögonkontakt
- 2.2 Hudkontakt
- 2.3 Inandning
- 2.4 Förtäring
- 3 användningsområden
- 3.1 1- Livsmedelsindustrin
- 3.2 2- Gruv- och metallindustrin
- 3.3 3- Laboratoriereagens
- 4 Referenser
Fysiska och kemiska egenskaper
Kaliumferrocyanid är en monoklinisk kristall av gul eller blekgul färg, beroende på hydratiseringsnivån, utan en karakteristisk arom (National Center for Biotechnology Information., 2017). Dess utseende visas i figur 2 (Kaliumferrocyanid, 2017).

Föreningen har en molekylvikt av 368,35 g / mol för den vattenfria formen och 422,388 g / mol för trihydratformen. Den har en densitet på 1,85 g / ml och en smältpunkt på 70 ° C där den börjar sönderdelas (Royal Society of Chemistry, 2015).
Föreningen är löslig i vatten och kan lösa 28,9 gram förening i 100 ml av detta lösningsmedel. Det är olösligt i dietyleter, etanol och toluen. Föreningen reagerar på värme för att bilda kaliumcyanid enligt reaktionen:
K4[Faith (CN)6] → 4 KCN + FeCtvå + Ntvå
I kombination med koncentrerade syror bildar den vätecyanid (HCN) som är en mycket giftig, brandfarlig gas och kan bilda explosiva blandningar i luften (Laffort, 2001).
Reaktivitet och faror
Kaliumferrocyanid är en stabil förening, oförenlig med starka syror och oxidationsmedel. Kaliumferrocyanid är giftfri och bryts inte ned i cyanid i kroppen. Toxicitet hos råttor är låg, med en dödlig dos (LD50) vid 6400 mg / kg.
Ämnet är giftigt för lungor och slemhinnor. Föreningen kan orsaka irritation vid kontakt med hud och ögon..
Vid intag kan det orsaka irritation i mag-tarmkanalen och vid inandning orsakar det irritation i nässlemhinnan och andningsorganen..
Kontakt med ögonen kan leda till hornhinneskador eller blindhet. Kontakt med huden kan orsaka inflammation och blåsor.
Inandning av damm kommer att ge irritation i mag-tarmkanalen eller luftvägarna, som kännetecknas av sveda, nysningar och hosta. Allvarlig överexponering kan orsaka lungskador, kvävning, medvetslöshet eller dödsfall..
Ögonkontakt
Vid kontakt med ögonen bör kontaktlinserna kontrolleras och tas bort. Ögonen ska spolas omedelbart med mycket kallt vatten i minst 15 minuter.
Hudkontakt
Det drabbade området ska sköljas omedelbart med mycket vatten i minst 15 minuter medan du tar bort förorenade kläder och skor. Täck irriterad hud med ett mjukgörande medel.
Tvätta kläder och skor före återanvändning. Om kontakten är svår, tvätta med desinfektionsmedel och täck den förorenade huden med en antibakteriell kräm.
Inandning
Offret ska flyttas till en sval plats. Om det inte andas bör artificiell andning ges. Om det är svårt att andas, ge syre.
Förtäring
Om föreningen intas ska kräkningar inte induceras såvida det inte föreskrivs av medicinsk personal. Lossa trånga kläder som en skjortkrage, bälte eller slips.
I samtliga fall bör läkare omedelbart fås omedelbart (Säkerhetsdatablad Kaliumferrocyanidtrihydrat, 2013).
Applikationer
1- Livsmedelsindustrin
Preussisk gul är också känd för sitt godkända europeiska livsmedelstillsatsnummer: E536 och har olika användningsområden inom livsmedelsindustrin. Det används som ett antiklumpmedel för både vägsalt och bordssalt.
Det har också en oenologisk användning för att ta bort koppar och järn vid vinframställning. Koppar används som fungicider i druvor (Wageningen University, 2014).
Den används också för jäsning av citronsyra (D. S. Clark, 1965). Kaliumferrocyanid kan också användas som gödningsmedel för växter.
2- Gruv- och metallindustrin
Kaliumferrocyanid används för att ta bort koppar från molybdenmineraler. Det används också för cementering av stål (Kaliumferrocyanid, K4Fe (CN) 6, 2012).
Cementering är en termokemisk behandling som appliceras på ståldelar. Processen tar kol till ytan genom diffusion, som impregneras genom att modifiera dess sammansättning.
3- Laboratoriereagens
Kaliumferrocyanid används för att bestämma koncentrationen av kaliumpermanganat, en förening som ofta används i titreringar baserat på redoxreaktioner..
Kaliumferrocyanid används i en blandning med kaliumferricyanid och fosfatbuffrad lösning för att tillhandahålla en buffert för beta-galaktosidas, som används för att klyva X-Gal (5-bromo-4-klor-3-indolyl-β-D-galaktopyranosid, ger en ljusblå visualisering där en antikropp (eller annan molekyl), konjugerad till Beta-gal, har bundet till sitt mål.
Föreningen används också för produktion av preussisk blå. När det reagerar med Fe (III) ger det en preussisk blå färg, varför det används som ett identifieringsreagens för järn i laboratorier..
Det används också för bestämning av zink i zinksulfidprover. Provet löses i HCl 6N och koka under en huva för att avlägsna vätesulfid, neutralisera med ammoniumhydroxid och tillsätt 3 droppar HCl.
Värm till kokning och tillsätt 5 ml lösning 1N av kaliumferrocyanid. Närvaron av en vit zinkferrocyanidfällning indikerar ett positivt test för detta element (Mehlig, 1927).
Referenser
- S. Clark, K. I. (1965). Effekt av kaliumferrocyanid på den kemiska sammansättningen av melassmos som används vid citronsyrajäsning. Bioteknik och bioteknik Volym 7, nummer 2, 269-278. Återställd från onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 januari). kaliumhexacyanoferrat (4−). Återställd från ebi.ac.uk.
- (2001, 5 mars). POTASSIUMFERROCYANURE. Återställd från laffort.com.
- Säkerhetsdatablad Kaliumferrocyanidtrihydrat. (2013, 21 maj). Återställd från sciencelab.com.
- Mehlig, J. P. (1927). Användning av kaliumferrocyanid som ett bekräftande test för zink. Kemisk utbildning.4 (6), 722. Återställd från pubs.acs.org.
- Nationellt centrum för bioteknikinformation ... (2017, 15 april). PubChem Compound Database; CID = 161067. Återställd från pubchem.ncbi.nlm.nih.gov.
- Kaliumferrocyanid. (2017, 25 mars). Återställd från sciencemadness.org.
- Kaliumferrocyanid, K4Fe (CN) 6. (2012). Återställd från atomistry.com.
- Royal Society of Chemistry. (2015). kaliumferrocyanid. Återställd från chemspider.com.
- Wageningen University. (2014, 14 augusti). E536: Kaliumferrocyanid. Återställd från food-info.net.



Ingen har kommenterat den här artikeln än.