
Fluorhistoria, egenskaper, struktur, erhållande, risker, användningar
De fluor Det är ett kemiskt grundämne som representeras av symbolen F och huvudgrupp 17, som halogener tillhör. Det särskiljs ovanför de andra elementen i det periodiska systemet, eftersom det är det mest reaktiva och elektronegativa; reagerar med nästan alla atomer, så det bildar otaliga salter och organfluorerade föreningar.
Under normala förhållanden är det en blekgul gas som kan förväxlas med gulgrön. I flytande tillstånd, som visas på bilden nedan, intensifierar den gula färgen lite mer, vilket försvinner helt när det stelnar vid fryspunkten..

Sådan är dess reaktivitet, trots gasens flyktiga natur, att den förblir fast i jordskorpan; särskilt i form av mineralet fluorit, känt för sina violetta kristaller. På samma sätt gör dess reaktivitet det till ett potentiellt farligt ämne; reagerar kraftigt på allt det rör vid och brinner i lågor.
Många av dess biprodukter kan dock vara ofarliga och till och med fördelaktiga, beroende på deras applikationer. Till exempel är den mest populära användningen av fluorid, tillsatt i jonisk eller mineralisk form (såsom fluoridsalter), beredning av fluortandkräm, som hjälper till att skydda tandemaljen..
Fluor har den egenskapen att det kan stabilisera de höga siffrorna eller oxidationstillstånden för många andra element. Ju högre antal fluoratomer, desto mer reaktiv är föreningen (såvida den inte är en polymer). Likaså kommer dess effekter med molekylära matriser att öka; för bättre eller sämre.
Artikelindex
- 1 Historia
- 1.1 Användning av fluorit
- 1.2 Framställning av fluorvätesyra
- 1.3 Isolering
- 1.4 Intresse för fluor
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Utseende
- 2.2 Atomnummer (Z)
- 2.3 Atomvikt
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Förångningsvärme
- 2.8 Molär värmekapacitet
- 2.9 Ångtryck
- 2.10 Värmeledningsförmåga
- 2.11 Magnetisk ordning
- 2.12 Lukt
- 2.13 oxidationsnummer
- 2.14 Joniseringsenergi
- 2.15 Elektronegativitet
- 2.16 Oxiderande medel
- 2.17 Reaktivitet
- 3 Struktur och elektronisk konfiguration
- 3.1 Diatomisk molekyl
- 3.2 Flytande och fast
- 4 Var att hitta och få
- 4.1 Fluoritbearbetning
- 4.2 Elektrolys av vätefluorid
- 5 isotoper
- 6 Biologisk roll
- 7 risker
- 7.1 Tandfluoros
- 7.2 Skelettfluoros
- 8 användningsområden
- 8.1 Tandkräm
- 8.2 Vattenfluoridering
- 8.3 Oxidationsmedel
- 8.4 Polymerer
- 8.5 Apotekare
- 8.6 Glasetsning
- 8.7 Anrikning av uran
- 9 Referenser
Berättelse
Användning av fluorit
År 1530 upptäckte den tyska mineralogen Georgius Agricola att mineralfluorsparet kunde användas vid rening av metaller. Fluorspar är ett annat namn för fluorit, ett fluormineral som bestod av kalciumfluorid (CaFtvå).
Elementet fluor hade inte upptäckts då och "fluoaren" i fluorit kom från det latinska ordet "fluere" som betyder "att flöda"; eftersom detta var precis vad fluorspar eller fluorit gjorde med metaller: det hjälpte dem att lämna provet.
Framställning av fluorvätesyra
År 1764 lyckades Andreas Sigismud Margraff bereda fluorvätesyra och värma upp fluorit med svavelsyra. Glasretorterna smältes av syran, så glaset ersattes av metaller.
Det tillskrivs också Carl Scheele 1771, beredningen av syran med samma metod följt av Margraff. 1809 föreslog den franska forskaren Andre-Marie Ampere att fluor- eller fluorvätesyra var en förening som består av väte och ett nytt grundämne som liknar klor..
Forskare försökte isolera fluorid genom att använda fluorvätesyra under lång tid; men dess farlighet försvårade framsteg i denna mening.
Humphry Davy, Joseph Louis Gay-Lussac och Jacques Thénard hade svår smärta när de inhalerade vätefluorid (fluorvätesyra utan vatten och i gasform). Forskare Paulin Louyet och Jerome Nickles dog av förgiftning under liknande omständigheter.
Edmond Frémy, en fransk forskare, försökte skapa torr fluorvätesyra för att undvika vätefluoridtoxicitet genom försurning av kaliumbifluorid (KHFtvå), men under elektrolysen fanns ingen ledning av den elektriska strömmen.
Isolering
1860 försökte den engelska kemisten George Gore elektrolysera torr fluorvätesyra och lyckades isolera en liten mängd fluorgas. En explosion inträffade dock när väte och fluor återförenades våldsamt. Gore tillskrev explosionen ett syreläckage..
År 1886 lyckades den franska kemisten Henri Moisson isolera fluor för första gången. Tidigare avbröts Moissons arbete fyra gånger av allvarlig vätefluoridförgiftning, samtidigt som man försökte isolera grundämnet..
Moisson var Frémys student och litade på sina experiment för att isolera fluor. Moisson använde en blandning av kaliumfluorid och fluorvätesyra i elektrolysen. Den resulterande lösningen ledde elektricitet och fluorgas uppsamlad vid anoden; det vill säga vid den positivt laddade elektroden.
Moisson använde korrosionsbeständig utrustning, där elektroderna var gjorda av en legering av platina och iridium. I elektrolysen använde han en platinabehållare och kyldes elektrolytlösningen till en temperatur av -23 ° F (-31 ° C)..
Slutligen, den 26 juni 1886, lyckades Henri Moissson isolera fluor, ett arbete som gjorde det möjligt för honom att vinna Nobelpriset 1906.
Intresse för fluor
Intresset för fluorforskning förlorades en tid. Men utvecklingen av Manhattan-projektet för produktion av atombomben, ökade det igen.
Mellan åren 1930 och 1940 utvecklade det amerikanska företaget Dupont fluorerade produkter såsom klorfluorkolväten (Freon-12), som användes som kylmedel; och polytetrafluoroetenplast, bättre känd under namnet Teflon. Detta gav en ökning av produktionen och konsumtionen av fluor..
År 1986 presenterade den amerikanska kemisten Karl O. Christe en kemisk metod för framställning av fluor vid en konferens omkring hundra år från isoleringen av fluor.tvåMnF6 och SbF5.
Fysiska och kemiska egenskaper
Utseende
Fluor är en blekgul gas. I flytande tillstånd är den ljusgul. Under tiden kan det fasta ämnet vara ogenomskinligt (alfa) eller transparent (beta).
Atomnummer (Z)
9.
Atomvikt
18.998 u.
Smältpunkt
-219,67 ºC.
Kokpunkt
-188.11 ºC.
Densitet
Vid rumstemperatur: 1.696 g / L..
Vid smältpunkt (flytande): 1,505 g / ml.
Förångningsvärme
6,51 kJ / mol.
Molär värmekapacitet
31 J / (mol K).
Ångtryck
Vid en temperatur på 58 K har det ett ångtryck på 986,92 atm.
Värmeledningsförmåga
0,0277 W / (m K)
Magnetisk ordning
Diamagnetisk
Odör
Karakteristisk skarp och skarp lukt, detekterbar även vid 20 ppb.
Oxidationsnummer
-1, vilket motsvarar fluoranjonen, F-.
Joniseringsenergi
-Först: 1 681 kJ / mol
-Andra: 3 374 kJ / mol
-Tredje: 6,147 KJ / mol
Elektronnegativitet
3,98 på Pauling-skalan.
Det är det kemiska grundämnet med de högsta elektronegativiteterna; det vill säga den har hög affinitet för elektronerna i atomerna som den binder med. På grund av detta genererar fluoratomer stora dipolmoment i specifika regioner i en molekyl..
Dess elektronegativitet har också en annan effekt: atomerna bundna till den förlorar så mycket elektrontäthet att de börjar få en positiv laddning; detta är ett positivt oxidationsnummer. Ju fler fluoratomer det finns i en förening, kommer den centrala atomen att ha ett mer positivt oxidationsnummer..
Till exempel i OFtvå syre har ett oxidationsnummer på +2 (Otvå+Ftvå-); i UF6, Uran har ett oxidationsnummer på +6 (U6+F6-); detsamma händer med svavel i SF6 (S6+F6-); och slutligen finns AgFtvå, där silver till och med har ett oxidationsnummer på +2, sällsynt för det.
Därför lyckas elementen delta med sina mest positiva oxidationsnummer när de bildar föreningar med fluor..
Oxiderande medel
Fluor är det mest kraftfulla oxiderande elementet, så inget ämne kan oxidera det; och av denna anledning finns den inte fri i naturen.
Reaktivitet
Fluor kan kombineras med alla andra element utom helium, neon och argon. Det attackerar inte heller mjukt stål eller koppar vid normala temperaturer. Reagerar våldsamt med organiska material som gummi, trä och tyg.
Fluor kan reagera med ädelgasen xenon för att bilda den starka oxidationsmedlet xenondifluorid, XeFtvå. Det reagerar också med väte för att bilda en halogenid, vätefluorid, HF. I sin tur löses vätefluorid i vatten för att producera den berömda fluorvätesyran (som glas).
Surheten hos de sura syrorna, klassificerad i ökande ordning, är:
HF < HCl < HBr < HI
Salpetersyra reagerar med fluor för att bilda fluornitrat, FNO3. Under tiden reagerar saltsyra kraftigt med fluor för att bilda HF, OFtvå och ClF3.
Struktur och elektronisk konfiguration

Diatomisk molekyl

Fluoratomen i sitt jordtillstånd har sju valenselektroner, som befinner sig i 2s och 2p orbitaler enligt den elektroniska konfigurationen:
[Han] 2stvå 2 s5
Valensbindningsteorin (VTE) anger att två fluoratomer, F, är kovalent bundna till var och en fullbordar sin valensoktet.
Detta händer snabbt eftersom det krävs bara en elektron för att bli isoelektronisk mot neon-ädelgasen; och dess atomer är mycket små, med en mycket stark effektiv kärnladdning som lätt kräver elektroner från omgivningen.
Molekylen Ftvå (toppbild), har en enda kovalent bindning, F-F. Trots dess stabilitet jämfört med fria F-atomer är det en mycket reaktiv molekyl; homonukleär, apolär och ivrig efter elektroner. Det är därför fluor, som Ftvå, det är en mycket giftig och farlig art.
Eftersom Ftvå är apolär, dess interaktioner beror på dess molekylvikt och Londons spridningskrafter. Vid något tillfälle måste det elektroniska molnet runt båda F-atomerna deformeras och utgöra en ögonblicklig dipol som inducerar en annan i en angränsande molekyl; så att de lockar varandra långsamt och svagt.
Flytande och fast
Molekylen Ftvå den är väldigt liten och sprids relativt snabbt i rymden. I sin gasformiga fas uppvisar den en ljusgul färg (som kan förväxlas med limegrön). När temperaturen sjunker till -188 ºC blir dispersionskrafterna effektivare och gör F-molekylernatvå samlas nog för att definiera en vätska.
Flytande fluor (första bilden) ser ännu mer gul ut än respektive gas. I den har molekylerna Ftvå de är närmare och interagerar med ljus i större utsträckning. Intressant är att när den förvrängda kubiska fluorkristallen bildas vid -220 ° C bleknar färgen och förblir som en transparent fast substans..
Nu när F-molekylernatvå är så nära (men utan att deras molekylära rotationer stannar), det verkar som om deras elektroner får en viss stabilitet och därför är deras elektroniska hopp för stort för att ljuset ens ska interagera med kristallen.
Kristallina faser
Denna kubiska kristall motsvarar β-fasen (den är inte en allotrop eftersom den fortfarande är samma Ftvå). När temperaturen sjunker ytterligare, ner till -228 ºC, genomgår den fasta fluoren en fasövergång; den kubiska kristallen blir en monoklinisk, a-fasen:
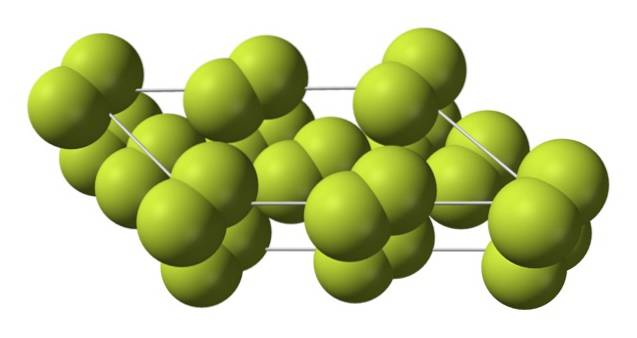
Till skillnad från β-Ftvå, a-Ftvå den är ogenomskinlig och hård. Kanske beror det på att F-molekylernatvå de har inte längre så mycket frihet att rotera i sina fasta positioner på monokliniska kristaller; där de i större utsträckning interagerar med ljus, men utan att spänna sina elektroner (vilket ytligt skulle förklara deras opacitet).
Kristallstrukturen hos α-Ftvå det var svårt att studera med konventionella röntgendiffraktionsmetoder Detta beror på att övergången från β till α-fasen är mycket exoterm; så kristallen exploderade praktiskt taget, samtidigt som den hade liten interaktion med strålning.
Det tog ungefär femtio år innan tyska forskare (Florian Kraus et al.) Helt dechiffrerade strukturen av α-Ftvå mer exakt tack vare neutrondiffraktionstekniker.
Var att hitta och få
Fluor rankas som 24: e bland de vanligaste elementen i universum. Men på jorden är det massa 13vo element, med en koncentration på 950 ppm i jordskorpan och en koncentration på 1,3 ppm i havsvatten.
Jord har en fluorkoncentration mellan 150 och 400 ppm, och i vissa jordar kan koncentrationen nå 1000 ppm. I atmosfärisk luft är den närvarande i en koncentration av 0,6 ppb; men det har spelats in i vissa städer upp till 50 ppb.
Fluor erhålls huvudsakligen från tre mineraler: fluorit eller fluorospar (CaFtvåfluoroapatit [Ca5(PO4)3F] och kryolit (Na3AlF6).
Fluoritbearbetning
Efter att ha samlat stenarna med mineralet fluorit utsätts de för en primär och sekundär krossning. Vid sekundär krossning erhålls mycket små bergfragment.
Bergfragmenten tas sedan till en kulkvarn för reduktion till pulver. Vatten och reagens tillsättes för att bilda en pasta som placeras i en flotationstank. Luft injiceras under tryck för att bilda bubblor och därmed hamnar fluoriten på den vattenhaltiga ytan.
Silikater och karbonater sätter sig ut medan fluorit samlas upp och tas till torkugnar..
När fluoriten väl erhållits reageras den med svavelsyra för att producera vätefluorid:
CaFtvå + HtvåSW4 => 2 HF + CaSO4
Elektrolys av vätefluorid
Vid produktionen av fluor följs metoden som användes av Moisson 1886, med vissa modifieringar..
En elektrolys görs av en blandning av smält kaliumfluorid och fluorvätesyra, med ett molförhållande av 1: 2,0 till 1: 2,2. Temperaturen på det smälta saltet är 70 - 130 ºC.
Katoden består av en Monel-legering eller stål och anoden är degrafitkol. Fluorproduktionsprocessen under elektrolys kan beskrivas enligt följande:
2HF => Htvå + Ftvå
Vatten används för att kyla elektrolyskammaren, men temperaturen måste vara över elektrolytens smältpunkt för att undvika stelning. Väte som produceras i elektrolys samlas upp vid katoden, medan fluor vid anoden.
Isotoper
Fluor har 18 isotoper, som är 19F den enda stabila isotopen med 100% överflöd. De 18F har en halveringstid på 109,77 minuter och är den radioaktiva isotopen av fluor med den längsta halveringstiden. De 18F används som en källa till positroner.
Biologisk roll
Det finns ingen känd metabolisk aktivitet av fluor i däggdjur eller högre växter. Vissa växter och marina svampar syntetiserar emellertid monofluoracetat, en giftig förening, som de använder som ett skydd för att förhindra dess förstörelse.
Risker
Överdriven konsumtion av fluor har associerats med benfluoros hos vuxna och tandfluoros hos barn, liksom förändringar i njurfunktionen. Av denna anledning föreslog den amerikanska folkhälsovården (PHS) att fluorkoncentrationen i dricksvatten inte skulle vara större än 0,7 mg / l.
Under tiden konstaterade The US Enviromental Protection Agency (EPA) att koncentrationen av fluor i dricksvatten inte borde vara större än 4 mg / l för att undvika skelettfluoros, där fluor ackumuleras i benen. Detta kan leda till försvagning av benet och frakturer..
Fluor har associerats med skador på bisköldkörteln, med en minskning av kalcium i benstrukturer och höga koncentrationer av kalcium i plasma.
Bland förändringarna som tillskrivs överflödig fluor är följande: tandfluoros, skelettfluoros och skada på bisköldkörteln.
Tandfluoros
Tandfluoros uppträder med små ränder eller fläckar i tandemaljen. Barn under 6 år bör inte använda fluorinnehållande munvatten..
Skelettfluoros
Vid skelettfluoros kan smärta och skador på benen samt lederna diagnostiseras. Benet kan härda och förlora elasticitet, vilket ökar risken för frakturer.
Applikationer
Tandkräm

Vi börjar med avsnittet om användningen av fluor med det som är mest känt: det att tjäna som en komponent i många tandkrämer. Detta är inte den enda användningen där kontrasten mellan dess F-molekyl uppskattastvå, extremt giftigt och farligt, och anjonen F-, vilket beroende på din miljö kan vara till nytta (men ibland inte).
När vi äter mat, särskilt godis, bryter bakterier ner det genom att öka surheten i vår saliv. Sedan kommer det en punkt där pH-värdet är tillräckligt surt för att bryta ner och demineralisera tandemaljen; hydroxiapatit går sönder.
I denna process är dock jonerna F- interagera med Catvå+ att bilda en fluorapatitmatris; mer stabil och hållbar än hydroxiapatit. Eller åtminstone är detta den föreslagna mekanismen för att förklara effekten av fluoranjon på tänderna. Det är troligtvis mer komplext och har en pH-beroende hydroxiapatit-fluorapatitbalans.
Dessa anjoner F- De finns i tandväxter i form av salter; såsom: NaF, SnFtvå (den berömda tennfluoriden) och NaPOF. Koncentrationen av F- Det måste vara lågt (mindre än 0,2%), eftersom det annars orsakar negativa effekter på kroppen.
Fluorisering av vatten
På samma sätt som tandkräm har fluorsalter tillsatts i dricksvattenkällor för att bekämpa håligheter hos dem som dricker det. Koncentrationen bör fortfarande vara mycket lägre (0,7 ppm). Men denna praxis är ofta föremål för misstro och kontroverser, eftersom det har tillskrivits möjliga cancerframkallande effekter.
Oxiderande medel
Gas Ftvå det beter sig som ett mycket starkt oxidationsmedel. Detta gör att många föreningar brinner snabbare än när de utsätts för syre och en värmekälla. Det är därför det har använts i raketbränsleblandningar, där det till och med kan ersätta ozon.
Polymerer
I många användningar beror inte fluors bidrag på Ftvå eller F-, men direkt till dess elektronegativa atomer som en del av en organisk förening. I huvudsak talar vi om en C-F-länk..
Beroende på strukturen är polymerer eller fibrer med C-F-bindningar vanligtvis hydrofoba, så de blir inte våta eller motstår attacken av fluorvätesyra; Eller ännu bättre, de kan vara utmärkta elektriska isolatorer och användbara material som föremål som rör och packningar är tillverkade av. Teflon och nafion är exempel på dessa fluorerade polymerer.
Apotekare
Reaktiviteten hos fluor gör det användbar för syntes av flera fluorföreningar, organiska eller oorganiska, ifrågasatta. I organiska ämnen, särskilt de med farmakologiska effekter, ersätter en av deras heteroatomer med F-atomer (positivt eller negativt) deras verkan på deras biologiska mål..
Det är därför inom läkemedelsindustrin som modifiering av vissa läkemedel genom tillsats av fluoratomer alltid ligger på bordet..
Mycket liknande händer med herbicider och fungicider. Fluoriden i dem kan öka deras verkan och effektivitet på skadedjur av insekter och svampar..
Glasstick
Fluorsyra har, på grund av sin aggressivitet med glas och keramik, använts för att gravera tunna och känsliga bitar av dessa material; vanligtvis avsedda för tillverkning av mikrokomponenter till datorer eller för elektriska lampor.
Uranberikning
En av de mest relevanta användningarna av elementärt fluor är att hjälpa till att berika uran som 235U. För detta upplöses uranmineraler i fluorvätesyra, vilket ger UF4. Denna oorganiska fluorid reagerar sedan med Ftvå, för att på så sätt förvandlas till UF6 (235PHEW6 Y 238PHEW6).
Därefter, och genom gascentrifugering, 235PHEW6 skiljer sig från 238PHEW6 för att senare oxideras och lagras som kärnbränsle.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Krämer Katrina. (2019). Fryst fluor struktur återupptas efter 50 år. Royal Society of Chemistry. Återställd från: chemistryworld.com
- Wikipedia. (2019). Fluor. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Fluor. PubChem-databas. CID = 24524. Återställd från: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fakta om fluorelement. Chemicool. Återställd från: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21 februari). Den överraskande vanliga användningen av mycket reaktivt fluor. Återställd från: sciencestruck.com
- Paola Opazo Sáez. (04 februari 2019). Fluor i tandkräm: är det bra eller dåligt för din hälsa? Återställd från: nacionfarma.com
- Karl Christe & Stefan Schneider. (8 maj 2019). Fluor: kemiskt grundämne. Encyclopædia Britannica. Återställd från: britannica.com
- Lenntech B.V. (2019). Periodiskt system: syre. Återställd från: lenntech.com
- Gagnon Steve. (s.f.). Elementet fluor. Jefferson Lab. Återställd från: education.jlab.org
- American Cancer Society medicinskt och redaktionellt innehållsteam. (2015, 28 juli). Vattenfluoridering och cancerrisk. Återställd från: cancer.org

Ingen har kommenterat den här artikeln än.