
Minsta formel hur man får minsta formel, exempel och övningar
De minimal eller empirisk formel Det är ett uttryck för den andel i vilken atomerna hos de olika elementen som utgör en kemisk förening är närvarande. Minimiformeln är således den enklaste representationen av en kemisk förening. Det är därför det är 'minimalt'.
Minimiformeln uttrycker inte antalet atomer för de olika elementen som utgör en kemisk förening; men den andel i vilken dessa atomer kombineras för att generera den kemiska föreningen.
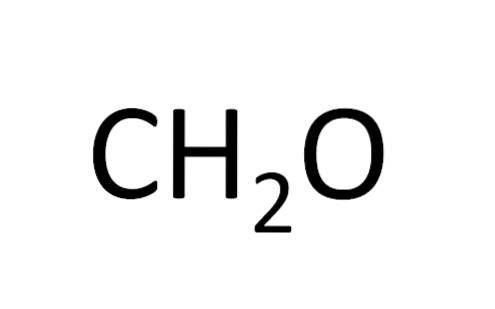
Minsta formeln kallas också den empiriska formeln, eftersom den erhålls från experiment; det vill säga det är relaterat till erfarenhet. Experimentell observation tillät att dra slutsatsen att två väteatomer kombineras med en väteatom för att bilda vatten (HtvåELLER).
I många fall matchar minimiformeln molekylformeln. I molekylen visas det verkliga antalet av de olika elementen som utgör en kemisk förening; sådant är exempelvis fallet med svavelsyra (HtvåSW4).
Men i andra fall finns det ingen tillfällighet mellan minimiformeln och molekylformeln; Så är fallet med bensen: minsta formel är CH, medan dess molekylformel är C6H6.
Artikelindex
- 1 Hur får man minsta formel?
- 1.1 Första steget
- 1.2 Andra steget
- 1.3 Tredje steget
- 1.4 Fjärde steget
- 2 Exempel på minimiformel
- 2.1 Vatten och koldioxid
- 2.2 Bas- och syraoxider
- 2.3 ättiksyra
- 2.4 Smörsyra
- 2.5 Etylenglykol
- 2.6 Bensen
- 2.7 Glukos
- 3 Lösta övningar
- 3.1 - Övning 1
- 3.2 - Övning 2
- 4 Referenser
Hur får man lägsta formel?
Första steget
Hitta gram för varje element som finns i föreningen. Eftersom de vanligtvis uttrycks som en procentandel av massan av föreningen måste en enkel beräkning göras för omvandlingen av massprocenthalten i elementen.
Andra steg
Det relativa antalet atomer för de olika elementen som utgör den kemiska föreningen erhålls. För att göra detta delas massan av varje element, uttryckt i gram, med dess atommassa.
Vissa författare föredrar att kalla det relativa antalet atomer, eftersom antalet mol atomer av de element som ingår i den kemiska föreningen.
Tredje steget
Att erhålla den minsta andelen, uttryckt i heltal, av var och en av de atomer som finns i den kemiska föreningen.
För att hitta dessa värden, dela det relativa antalet för varje atom som finns i föreningen med det minsta relativa numeriska värdet som en atom har i den kemiska föreningen..
Om värdet på minsta andel av en atom inte är ett heltal utan decimaler, måste alla värden för minsta andel multipliceras med ett tal; på ett sådant sätt att det gör att alla värden för minsta andel kan vara heltal.
Till exempel, om värdet på den minsta andelen av en atom av den kemiska föreningen är 2,5, multiplicera alla värdena för minsta andel av var och en av atomerna närvarande tider 2. Således kommer alla värden för minsta andel endast att vara heltal.
Fjärde steget
Skriv minsta formel för föreningen. Värdena för minsta andel för atomerna för de olika elementen kommer att placeras som prenumerationer på de kemiska symbolerna för elementen för att skriva minsta formel.
Minsta formelexempel
Vatten och koldioxid
De flesta kemiska föreningar har formler som är både minimala och molekylära formler. Således är formeln för vatten (HtvåO) är en minimal formel; men det är också en molekylformel. Detsamma gäller formeln för koldioxid (COtvå).
Bas- och syraoxider
Bas- och syraoxider är kemiska föreningar som har kemiska formler, med få undantag som är både minimala och molekylära formler. Samma situation inträffar med hydroxider och syror, med undantag för vissa karboxylsyror..
Ättiksyra
Karboxylsyror som har ett jämnt antal kolatomer i sin sammansättning har separat en minimiformel och en molekylformel. Ättiksyra har till exempel en molekylformel (CtvåH4ELLERtvå); men den har också en minimal formel (CHtvåELLER).
Smörsyra
Smörsyra har också en molekylformel (C4H8ELLERtvå) och en minimal formel (CtvåH4ELLER).
Etylenglykol
Andra organiska föreningar har båda typerna av kemiska formler; sådant är fallet med etylenglykol, som har en molekylformel (CtvåH6ELLERtvåoch en minimal formel (CH3ELLER).
Bensen
Bensen, en aromatisk förening, har en molekylformel (C6H6) och en minimal formel (CH).
Glukos
Glukos har en molekylformel (C6H12ELLER6och en minimal formel (CHtvåELLER).
Lösta övningar
- Övning 1
Etylenglykol är en förening som används som frostskyddsmedel, den har en molekylvikt på 62,1 g / mol och en procentuell masskomposition enligt följande:
C: 38%,
H: 9,7%
Eller: 51,16%.
Första steget
Uttryck massprocenten av elementen i deras massa i gram. För detta tas molekylvikten för etylenglykol som referens. Om detta är 62,1 gram per mol består 38% av det av kol. Och så vidare med de andra elementen:
Kolmassa = 62,1 g (38/100)
= 23,6 g
Vätemassa = 62,1 g (9,7 / 100)
= 6,024 g
Massa av syre = 62,1 g (51,16 / 100)
= 31,77 g
Andra steg
Beräkna det relativa antalet varje närvarande atom (NRA) eller antalet mol för varje atom. För att göra detta delas massan av varje kemiskt element med sin atommassa.
NRA (C) = 23,6 g / 12 g
= 1,97
Kan avrundas till 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Kan avrundas till 6.
NRA (O) = 31,77 g / 16 g
= 1.985
Kan avrundas till 2.
Tredje steget
Beräkna det minsta heltalförhållandet för elementen i föreningen (PMNE). För att göra detta delar du vart och ett av värdena på de atomära relativa siffrorna (NRA) med det minsta värdet av detta. I detta fall 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Fjärde steget
Skriv minsta formel för etylenglykol:
CH3ELLER
Som framgår är värdena erhållna i steg 3 prenumerationer av föreningens element.
- Övning 2
Ättiksyra har en molekylvikt på 60 g / mol och följande massprocentkomposition:
C: 40%
H: 6,67%
Eller: 53,33%
Skaffa minimiformeln för föreningen.
Första steget
Omvandla elementens massprocent till massorna uttryckta i gram:
Kolmassa = 60 g (40/100)
= 24 g
Vätemassa = 60 g (6,67 / 100)
= 4 g
Massa av syre = 60 g (53,33 / 100)
= 32 g
Andra steg
Beräkna det relativa antalet atomer (NRA) av föreningen. För att göra detta divideras massorna av elementen med sina atommassor:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Tredje steget
Skaffa det minsta heltalförhållandet mellan elementen i föreningen (PMNE). För att göra detta delas elementens NRA-värden med det lägsta NRA-värdet som ett element har:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Fjärde steget
Skriv minsta formel för ättiksyra:
CHtvåELLER
Föreningsprenumerationerna är de värden som erhållits från PMNE.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (27 augusti 2019). Empirisk formel: definition och exempel. Återställd från: thoughtco.com
- Wikipedia. (2020). Empirisk formel. Återställd från: en.wikipedia.org
- Kemi LibreTexts. (03 juli 2019). Beräkning av empiriska formler för föreningar. Återställd från: chem.libretexts.org
- Nicola McDougal. (2020). Empirisk formel: definition, steg och exempel. Studie. Återställd från: study.com


Ingen har kommenterat den här artikeln än.