
Molekylformel hur man får det, exempel och övningar
De molekylär formel Det är en representation av en molekyl av en förening, där atomerna för alla element som finns i föreningen och deras antal indikeras av deras kemiska symboler. Varje atom åtföljs av ett underskrift.
Molekylformeln har begränsningen att den inte anger bindningarna för de olika atomerna i molekylen eller deras rumsliga förhållande; som strukturformeln gör. I vissa fall är det inte specifikt, till exempel: C6H12ELLER6 är molekylformeln glukos, galaktos och fruktos.
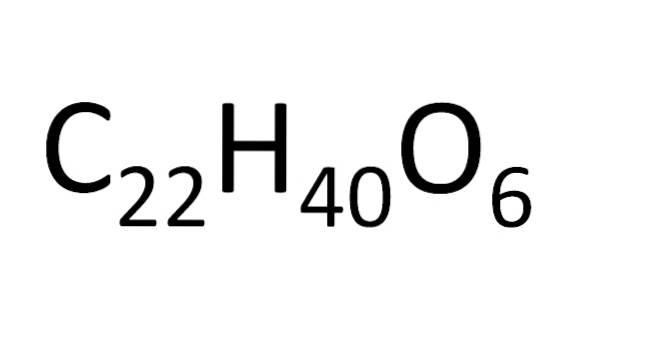
Det finns en uppsättning regler för arrangemang av atomer i en molekylformel. För joniska salter, t.ex. natriumklorid, är katjonssymbolen (Na+) och sedan anjon-symbolen (Cl-). Det är därför molekylformeln för natriumklorid är NaCl.
Molekylformeln för organiska föreningar skrivs genom att placera symbolen för kol (C) först, följt av symbolen för väte (H) och sedan de återstående atomerna. Exempelvis är ättiksyras molekylformel CtvåH4ELLERtvå.
Artikelindex
- 1 Hur får man molekylformeln
- 1.1 Första steget
- 1.2 Andra steget
- 1.3 Tredje steget
- 1.4 Fjärde steget
- 1.5 Femte steget
- 2 Exempel på molekylformler
- 3 Lösta övningar
- 3.1 - Övning 1
- 3.2 - Övning 2
- 4 Referenser
Hur får man molekylformeln
Att erhålla molekylformeln för en förening baseras på den tidigare fastställandet av dess minsta eller empiriska formel. Av denna anledning är de första stegen för att erhålla båda formlerna vanliga..
Första steget
Det är vanligt att uttrycka massan av elementen i en kemisk förening i procentuell form. En enkel beräkning måste sedan genomföras för att omvandla massprocenten för de olika elementen till deras massor uttryckta i gram..
Andra steg
Att känna till massan i gram av vart och ett av elementen och deras atommassa, det relativa antalet för varje atom eller antalet mol av varje atom kan erhållas genom att dela massan för vart och ett av de olika elementen med sin atommassa..
Tredje steget
Dela det relativa antalet alla atomerna, ange det relativa antalet mindre värde. Värdena för minsta andel måste vara heltal. Om ett värde av andelen innehåller ett decimal måste en korrigering göras för att decimaltalet försvinner.
Korrigeringen består av att multiplicera alla värden i proportionen med ett tal som returnerar heltal till alla värden. Till exempel, om ett värde på minsta andel är 1,25, måste alla värden multipliceras med fyra (4). Sedan 1,25 gånger 4 är lika med 5, ett heltal.
Fjärde steget
Alla kemiska symboler för grundämnena i föreningen kommer att placeras och med motsvarande abonnemang; det vill säga värdet på elementets minsta andel.
Femte steget
Minsta formeln för en förening kan omvandlas till dess molekylformel genom att erhålla förhållandet mellan molekylvikten för föreningen och vikten av dess minsta formel (n). Detta förhållande är detsamma som finns mellan molekylformeln och minimiformeln.
n = molekylvikt av förening / vikt med minsta formel
För att erhålla molekylformeln måste minimiformeln multipliceras med n. Detta innebär att var och en av prenumerationerna på minimiformeln måste multipliceras med n.
n = Molekylvikt / Minsta formelvikt
= Molekylformel / Minsta formel
Molekylformel = minsta formel
Exempel på molekylära formler
Några vanliga molekylformler listas nedan:
-Järnoxid (FeO)
-Natriumhydroxid (NaOH)
-Kaliumoxid (KtvåELLER)
-Perkloroxid (CltvåELLER7)
-Järnhydroxid [Fe (OH)3]
-Kalciumklorid (CaCltvå)
-Saltsyra (HCl)
-Natriumsulfat (NtvåSW4)
-Svavelsyra (HtvåSW4)
-Perbromsyra (HBrO4)
-Aluminiumklorid (AlCl3)
-Metan (CH4)
-Propan (C3H8)
-Etan (CtvåH6)
-Etylalkohol (CtvåH6ELLER)
-Ättiksyra (CtvåH4ELLERtvå)
-Bensen (C6H6)
-Glukos (C6H12ELLER6)
Lösta övningar
- Övning 1
Metylbensoat har följande massprocent:
C: 70,57%,
H: 5,93%
Eller: 23,49%
Och en molekylvikt på 136,1 g / mol. Bestäm molekylformeln.
Första steget
Det första steget är att uttrycka massprocenten av elementen i deras massor i gram, med vetskap om att massprocenthalterna är i förhållande till molekylvikten..
Av de 136,1 gram som motsvarar molen av föreningen representerar 70,57% endast kol. Och så vidare med de återstående elementen:
Kolmassa = 136,1 g (70,57 / 100)
= 96,05 g
Vätemassa = 136,1 g (5,93 / 100)
= 8,06 g
Massa av syre = 136,1 (23,49 / 100)
= 31,96 g
Andra steg
Vid utarbetandet av molekylformeln måste det relativa antalet atomer (NRA) bestämmas. För att göra detta divideras massorna av elementen med sina atommassor:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Tredje steget
Vi måste sedan beräkna elementens minimiproportioner (PME). För att göra detta delas alla NRA-värden med det lägsta NRA-värdet:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Fjärde steget
Skriv minsta formel för metylbensoat, baserat på det faktum att elementens prenumerationer är deras beräknade minsta proportioner:
C4H4ELLER
Femte steget
Slutligen måste molekylformeln för metylbensoat fastställas. Vi beräknar därför n:
n = molekylvikt / minsta formelvikt
Minst formelns vikt är 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Molekylformel = 2minimal formel
= 2 C.4H4ELLER
Metylbensoatmolekylformel = C8H8ELLERtvå
- Övning 2
Procentandelen av elementen som utgör bensen är följande:
C: 92,36%
H: 7,64%.
Molekylvikten för bensen är 78 g / mol. Bestäm din molekylformel.
Första steget
Omvandla elementens massprocent till massorna i gram:
Kolmassa = 78 g (92,36 / 100)
= 72,04 g
Vätemassa = 78 g (7,64 / 100)
= 5,96 g
Andra steg
Beräkning av det relativa antalet atomer (NRA). För att göra detta divideras massorna av elementen med sina atommassor:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Tredje steget
Beräkning av värdena för den minsta andelen av elementen (PME). Detta beräknas genom att dela NRA-värdena för alla poster med det minsta NRA-värdet:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Fjärde steget
Skriva minimiformeln för bensen med hänsyn till att elementens prenumerationer är värdena för den minsta andelen som beräknas.
Minsta bensenformel: CH
Femte steget
Upprättande av molekylformeln genom att beräkna förhållandet mellan molekylmassan och massan för minimiformeln:
n = Molekylvikt / Minsta formelns vikt
= 78 g / 13 g
n = 6
Molekylformel = minsta formel
= 6CH
= C6H6
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2020). Kemisk formel. Återställd från: en.wikipedia.org
- Gränslös inlärning. (s.f.). Molekylära formler. Återställd från: courses.lumenlearning.com
- Helmenstine, Anne Marie, Ph.D. (29 september 2019). Beräkna empiriska och molekylära formler. Återställd från: thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Hur man använder empiriska formler för att hitta molekylära formler. Återställd från: dummies.com


Ingen har kommenterat den här artikeln än.