
Halvutvecklad formel vad det är och exempel (metan, propan, butan ...)

De halvutvecklad formel, Även känd som den semi-strukturella formeln, är det en av de många möjliga representationer som kan ges till molekylen av en förening. Det är mycket återkommande inom organisk kemi, särskilt i akademiska texter, eftersom det visar korrekt ordning av en molekyl och dess kovalenta bindningar.
Till skillnad från den utvecklade formeln, som är densamma som strukturformeln, visar den här inte C-H-bindningarna, utan att utelämna dem för att förenkla representationen. Från denna formel kommer alla läsare att kunna förstå vad en molekyls ryggrad är; men inte dess geometri eller någon av de stereokemiska aspekterna.
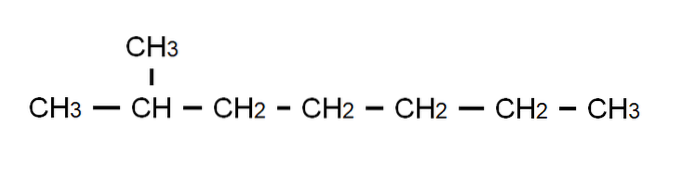
För att klargöra denna punkt har vi ovanför den halvutvecklade formeln för 2-metylheptan: en grenad alkan vars molekylformel är C8H18, och som följer den allmänna formeln CnH2n + 2. Observera att molekylformeln absolut inte säger något om strukturen, medan den halvutvecklade formeln redan gör det möjligt för oss att visualisera hur den här strukturen är..
Observera också att C-H-bindningarna utelämnas, och endast markerar de C-C-bindningar som utgör kolkedjan eller skelettet. Det framgår att för enkla molekyler sammanfaller den utvecklade formeln med den kondenserade formeln; och även med molekyläret.
Artikelindex
- 1 Exempel
- 1.1 Metan
- 1.2 Propan
- 1.3 Butan
- 1.4 Pentan
- 1,5 Etanol
- 1,6 dimetyleter
- 1.7 Cyklohexan
- 1.8 Fosforsyra
- 2 Allmän kommentar
- 3 Referenser
Exempel
Metan
Molekylformeln för metan är CH4, eftersom den har fyra C-H-bindningar och har tetrahedral geometri. Dessa data tillhandahålls av strukturformeln med kilar utanför eller under planet. För metan blir den kondenserade formeln också CH4, liksom det empiriska och halvutvecklade. Detta är den enda förening för vilken denna unikhet uppfylls..
Anledningen till att den halvutvecklade formeln för metan är CH4, det beror på att deras C-H-obligationer inte är skrivna; detta skulle motsvara strukturformeln.
Propan
Den halvutvecklade formeln för propan är CH3-CHtvå-CH3, med endast två C-C-obligationer. Dess molekyl är linjär, och om du märker det är dess kondenserade formel exakt densamma: CH3CHtvåCH3, den enda skillnaden är att C-C-obligationerna utelämnas. För propan är det sant att både den halvutvecklade och den kondenserade formeln sammanfaller.
I själva verket är detta sant för alla linjära kedjealkaner, vilket kommer att ses i följande avsnitt.
Butan
Den halvutvecklade formeln för butan är CH3-CHtvå-CHtvå-CH3. Observera att den kan skrivas på samma rad. Denna formel motsvarar strikt den n-butan, vilket indikerar att det är den linjära och ogrenade isomeren. Den grenade isomeren, 2-metylpropan, har följande halvutvecklade formel:
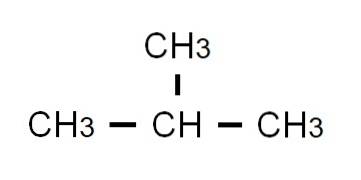
Den här gången kan den inte längre skrivas eller representeras på samma rad. Dessa två isomerer delar samma molekylformel: C4H10, som inte tjänar till att diskriminera varandra.
Pentan
Återigen har vi en annan alkan: pentan, vars molekylformel är C5H12. Den halvutvecklade formeln för n-pentan är CH3-CHtvå-CHtvå-CHtvå-CH3, lätt att representera och tolka, utan att behöva placera C-H-länkar. CH-grupper3 kallas metyl eller metyler och CHtvå är metylener.
Pentan har andra grenade strukturisomerer, som kan ses i den nedre bilden som representeras av deras respektive halvutvecklade formler:
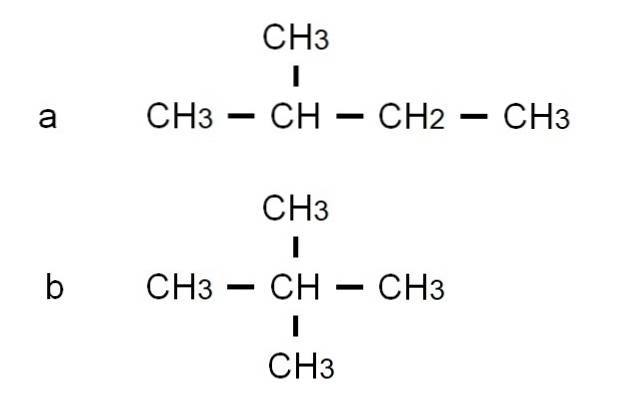
Isomeren till är 2-metylbutan, även kallad isopentan. Under tiden är isomeren b är 2,2-dimetylpropan, även känd som neopentan. Dess halvutvecklade formler gör skillnaden mellan de två isomererna tydliga; Men det säger inte mycket om hur sådana molekyler skulle se ut i rymden. För detta behövs strukturformler och modeller.
Etanol
Halvutvecklade formler används inte bara för alkaner, alkener eller alkyner utan för alla typer av organiska föreningar. Således har etanol, en alkohol, den halvutvecklade formeln: CH3-CHtvå-ÅH. Observera att en C-O-bindning nu representeras, men inte O-H-bindningen. Alla vätebindningar försummas.
Linjära alkoholer är lätta att representera liksom alkaner. Kort sagt: alla halvutvecklade formler för linjära molekyler är lätta att skriva.
Dimetyleter
Ethers kan också representeras med halvutvecklade formler. För fallet med dimetyleter, vars molekylformel är CtvåH6Eller det halvutvecklade blir: CH3-O-CH3. Observera att dimetyleter och etanol är strukturella isomerer, eftersom de delar samma molekylformel (räknar C-, H- och O-atomerna).
Cyklohexan
Halvutvecklade formler för grenade föreningar är mer tråkiga att representera än linjära; men ännu mer så är cykliska föreningar, såsom cyklohexan. Dess molekylformel motsvarar samma som för hexen och dess strukturella isomerer: C6H12, eftersom den sexkantiga ringen räknas som en omättnad.
För att representera cyklohexan dras en hexagonal ring vid vars hörn metylengrupperna kommer att vara placerade, CHtvå, precis som vi ser nedan:
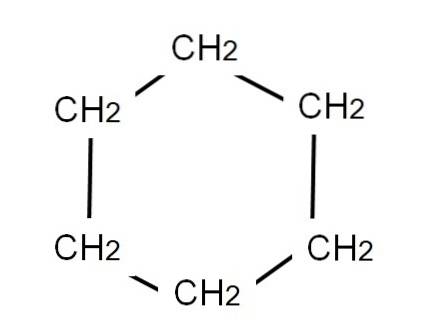
Den utvecklade formeln av cyklohexan skulle visa C-H-bindningarna, som om ringen hade TV-"antenner".
Fosforsyra
Molekylformeln för fosforsyra är H3PO3. För många oorganiska föreningar är molekylformeln tillräcklig för att ge dig en uppfattning om strukturen. Men det finns flera undantag, och detta är ett av dem. Med det faktum att H3PO3 är en diprotinsyra, den halvutvecklade formeln är: HPO (OH)två.
Det vill säga en av vätena är direkt bunden till fosforatomen. Formeln H3PO3 medger också en molekyl med halvutvecklad formel: PO (OH)3. Båda är i själva verket det som kallas tautomerer.
Halvutvecklade formler inom oorganisk kemi liknar mycket kondenserade i organisk kemi. I oorganiska föreningar, eftersom de inte har C-H-bindningar, och eftersom de i princip är enklare, är deras molekylformler vanligtvis tillräckliga för att beskriva dem (när de är kovalenta föreningar).
Generell kommentar
Halvutvecklade formler är mycket vanliga när eleven lär sig reglerna för nomenklatur. Men när de väl antagits är kemiska anteckningar i allmänhet fyllda med strukturformler av skelett-typ; det vill säga att inte bara C-H-länkarna utelämnas utan tid sparas också genom att ignorera C.
För resten är kondenserade formler mer återkommande inom organisk kemi än halvutvecklade, eftersom de förstnämnda inte ens behöver skriva länkarna som i den senare. Och när det gäller oorganisk kemi används dessa halvutvecklade formler mindre..
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2020). Halvutvecklad formel. Återställd från: es.wikipedia.org
- Siyavula. (s.f.). Organiska molekylära strukturer. Återställd från: siyavula.com
- Jean Kim & Kristina Bonnett. (05 juni 2019). Rita organiska strukturer. Kemi Libretexts. Återställd från: chem.libretexts.org
- Lärare. MARL och JLA. (s.f.). Introduktion till kolföreningar. [PDF]. Återställd från: ipn.mx



Ingen har kommenterat den här artikeln än.