
London tvingar fram egenskaper och exempel
De London styrkor, Spridningskrafter i London, eller inducerade dipol-dipolinteraktioner, är den svagaste typen av intermolekylära interaktioner. Dess namn beror på bidrag från fysikern Fritz London och hans studier inom kvantfysikområdet.
Londons krafter förklarar hur molekyler samverkar vars strukturer och atomer gör det omöjligt för honom att bilda en permanent dipol; det vill säga det gäller i princip apolära molekyler eller isolerade atomer av ädelgaser. Till skillnad från de andra Van der Waals-styrkorna kräver den här extremt korta avstånd.

En bra fysisk analogi av Londons styrkor finns i driften av kardborreförslutningssystemet (bilden ovan). Genom att trycka på ena sidan av tyget broderat med krokar och den andra med fibrer, skapas en attraktiv kraft som är proportionell mot tyget..
När båda ansikten är förseglade måste en kraft utövas för att motverka deras interaktioner (utförda av våra fingrar) för att separera dem. Detsamma gäller för molekyler: ju större eller mer platt de är, desto större är deras intermolekylära interaktioner på mycket korta avstånd..
Det är dock inte alltid möjligt att närma sig dessa molekyler på ett tillräckligt avstånd för att deras interaktioner ska vara märkbara..
När detta är fallet kräver de mycket låga temperaturer eller mycket höga tryck; som sådan är fallet med gaser. På samma sätt kan dessa typer av interaktioner förekomma i flytande ämnen (såsom n-hexan) och fasta ämnen (såsom jod)..
Artikelindex
- 1 Funktioner
- 1.1 Homogen lastfördelning
- 1.2 Polariserbarhet
- 1.3 Det är omvänt proportionellt mot avståndet
- 1.4 Den är direkt proportionell mot molekylmassan
- 2 Exempel på Londons styrkor
- 2.1 I naturen
- 2.2 Alkaner
- 2.3 Halogener och gaser
- 3 Referenser
Egenskaper
Vilka egenskaper måste en molekyl ha för att den ska kunna interagera med Londons krafter? Svaret är att vem som helst skulle kunna göra det, men när det finns ett permanent dipolmoment dominerar dipol-dipolinteraktioner mer än spridning, vilket bidrar väldigt lite till substansernas fysiska natur..
I strukturer där det inte finns några starkt elektronegativa atomer eller vars elektrostatiska laddningsfördelning är homogen, finns det ingen extremitet eller region som kan betraktas som rik (δ-) eller dålig (δ +) i elektroner.
I dessa fall måste andra typer av krafter ingripa eller annars kan dessa föreningar existera endast i gasfasen, oavsett tryck eller temperaturförhållanden som fungerar på dem..
Homogen lastfördelning
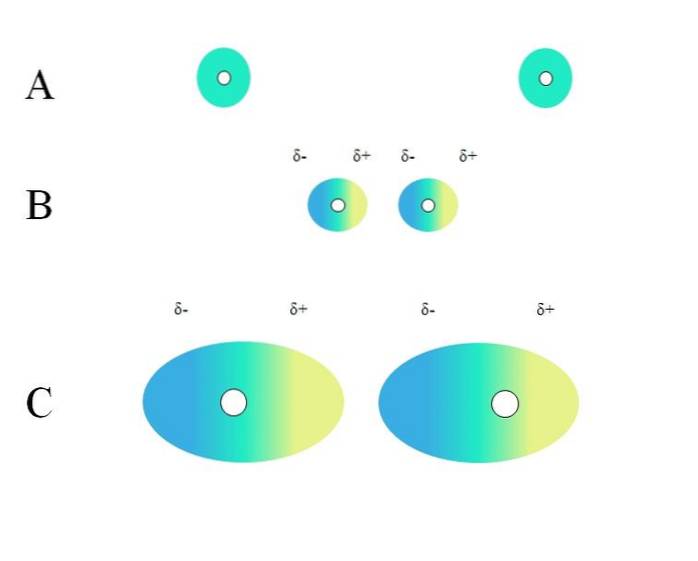
Två isolerade atomer, såsom neon eller argon, har en homogen laddningsfördelning. Detta kan ses i A, översta bilden. De vita cirklarna i mitten representerar kärnorna, för atomer eller molekylskelettet, för molekyler. Denna laddningsfördelning kan betraktas som ett grönt elektronmoln.
Varför uppfyller ädelgaser denna homogenitet? Eftersom de har sitt elektroniska skal helt fullt, så bör deras elektroner teoretiskt känna kärnans attraktiva laddning lika i alla orbitaler..
Å andra sidan, för andra gaser, såsom atomsyre (O), är dess skal ofullständigt (vilket observeras i sin elektroniska konfiguration) och tvingar det att bilda den diatomiska molekylen Otvå för att kompensera för denna brist.
De gröna cirklarna i A kan också vara molekyler, små eller stora. Dess elektronmoln kretsar kring alla atomer som utgör den, särskilt de mest elektronegativa. Runt dessa atomer kommer molnet att koncentreras och vara mer negativt, medan andra atomer kommer att ha en elektronisk brist.
Detta moln är dock inte statiskt utan dynamiskt, så vid något tillfälle kommer korta δ- och δ + -regioner att bildas, och ett fenomen kallas Polarisering.
Polariserbarhet
I A anger det gröna molnet en homogen fördelning av negativ laddning. Den positiva attraktionskraften som kärnan utövar kan emellertid svänga på elektronerna. Detta orsakar en deformation av molnet, vilket skapar regioner δ-, i blått och δ +, i gult..
Detta plötsliga dipolmoment i atomen eller molekylen kan förvränga ett intilliggande elektronmoln; med andra ord, det inducerar en plötslig dipol på sin granne (B, toppbild).
Detta beror på att δ-regionen stör det angränsande molnet, dess elektroner känner elektrostatisk avstötning och är orienterade vid motsatt pol och verkar δ+.
Observera hur de positiva polerna stämmer överens med de negativa polerna, precis som molekyler med permanenta dipolmoment gör. Ju mer voluminöst elektronmolnet är, desto svårare kommer kärnan att hålla det homogent i rymden; och också, ju större deformation av den, som kan ses i C..
Därför är det mindre troligt att atomer och små molekyler polariseras av någon partikel i sin omgivning. Ett exempel på denna situation illustreras med den lilla molekylen väte, Htvå.
För att den ska kondensera, eller till och med mer, för att kristallisera, behöver den orimliga tryck för att tvinga sina molekyler att fysiskt interagera.
Det är omvänt proportionellt mot avståndet
Även om ögonblickliga dipoler bildas som inducerar andra runt dem, räcker det inte för att hålla atomerna eller molekylerna ihop..
I B finns ett avstånd d som skiljer de två molnen och deras två kärnor. Så att båda dipolerna kan stanna under en övervägande tid, detta avstånd d den måste vara väldigt liten.
Detta villkor, ett väsentligt kännetecken för Londons styrkor (kom ihåg kardborreförslutningen), måste uppfyllas för att det ska få en märkbar effekt på materiens fysiska egenskaper..
En gång d är liten kommer kärnan till vänster i B att attrahera den blå δ- regionen hos den angränsande atomen eller molekylen. Detta kommer att deformera molnet ytterligare, sett i C (kärnan är inte längre i mitten utan till höger). Sedan kommer det en punkt där båda molnen berör och "studsar", men tillräckligt långsamt för att hålla dem ihop ett tag..
Därför är Londons styrkor omvänt proportionella mot avståndet d. Faktum är faktiskt lika med d7, så en liten variation i avståndet mellan de två atomerna eller molekylerna kommer att försvaga eller förstärka Londons spridning.
Det är direkt proportionellt mot molekylmassan
Hur ökar molnen så att de lättare polariseras? Lägga till elektroner, och för att kärnan måste ha fler protoner och neutroner, vilket ökar atommassan; eller, tillsätta atomer till molekylens ryggrad, vilket i sin tur skulle öka dess molekylvikt
På detta sätt skulle kärnorna eller molekylskelettet vara mindre benägna att hålla elektronmolnet enhetligt hela tiden. Därför, ju större de gröna cirklarna som betraktas i A, B och C, desto mer polariserbara kommer de att bli och desto större kommer också deras interaktioner av Londons styrkor..
Denna effekt observeras tydligt mellan B och C och kan vara ännu mer om cirklarna hade större diameter. Detta resonemang är nyckeln till att förklara de fysiska egenskaperna hos många föreningar baserat på deras molekylmassa..
Exempel på Londons styrkor

I naturen
I vardagen finns det otaliga exempel på Londons spridningskrafter utan att i första hand våga sig in i den mikroskopiska världen..
Ett av de vanligaste och överraskande exemplen finns i benen på reptiler som kallas geckos (toppbild) och i många insekter (även i Spiderman).
På benen har de dynor från vilka tusentals små filament sticker ut. På bilden kan du se en gecko som poserar i en klippas sluttning. För att uppnå detta använder den sig av de intermolekylära krafterna mellan berget och benens filament..
Var och en av dessa trådar samverkar svagt med ytan på vilken det lilla reptilen klättrar, men eftersom det finns tusentals av dem utövar de en kraft som är proportionell mot deras benområde, tillräckligt stark så att de förblir fästa och kan klättra. Geckos kan också klättra släta och perfekta ytor som glas..
Alkaner
Alkaner är mättade kolväten som också samverkar av Londons styrkor. Deras molekylära strukturer består helt enkelt av kol och väten förenade med enkelbindningar. Eftersom skillnaden i elektronegativitet mellan C och H är mycket liten är de apolära föreningar.
Således metan, CH4, det minsta kolvätet av alla, det kokar vid -161,7 ° C. När C och H tillsätts till skelettet erhålls andra alkaner med högre molekylmassor.
På detta sätt uppstår etan (-88,6 ° C), butan (-0,5 ° C) och oktan (125,7 ° C). Lägg märke till hur deras kokpunkter ökar när alkanerna blir tyngre.
Detta beror på att deras elektroniska moln är mer polariserbara och att deras strukturer har en större yta, vilket ökar kontakten mellan deras molekyler..
Oktan, även om det är en apolär förening, har en högre kokpunkt än vatten.
Halogener och gaser
Londons styrkor finns också i många gasformiga ämnen. Till exempel molekyler av Ntvå, Htvå, COtvå, Ftvå, Cltvå och alla ädelgaser, samverkar genom dessa krafter, eftersom de uppvisar homogen elektrostatisk fördelning, som kan drabbas av momentana dipoler och ge upphov till polarisationer.
Ädelgaserna är He (helium), Ne (neon), Ar (argon), Kr (krypton), Xe (xenon) och Rn (radon). Från vänster till höger ökar deras kokpunkter med ökande atommassor: -269, -246, -186, -152, -108 och -62 ºC.
Halogener interagerar också genom dessa krafter. Fluor är en gas vid rumstemperatur precis som klor. Brom, med en högre atommassa, finns under normala förhållanden som en rödaktig vätska, och jod bildar slutligen ett lila fast ämne som sublimerar snabbt eftersom det är tyngre än andra halogener.
Referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 452-455.
- Angeles Mendez. (22 maj 2012). Dispersionsstyrkor (från London). Återställd från: quimica.laguia2000.com
- London Dispersion Forces. Återställd från: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). 3 typer av intermolekylära krafter. Återställd från: thoughtco.com
- Ryan Ilagan & Gary L Bertrand. London dispersionsinteraktioner. Hämtad från: chem.libretexts.org
- ChemPages Netorials. Londons styrkor. Återställd från: chem.wisc.edu
- Kamereon. (22 maj 2013). Geckos: Gecko och Van der waals styrkor. Återställd från: almabiologica.com



Ingen har kommenterat den här artikeln än.