
Gasar egenskaper, beteende, form, exempel

De gaser De är alla dessa ämnen eller föreningar vars aggregeringstillstånd är svaga och spridda, samtidigt som de är mycket beroende av de tryck- och temperaturförhållanden som styr dem. De är kanske den näst vanligaste formen av materia i hela universum efter plasma..
På jorden utgör gaserna atmosfärens lager, från exosfären till troposfären och den luft vi andas in. Även om en gas är osynlig när den sprids genom stora utrymmen, såsom himlen, detekteras den av rörelse av moln, vändningarna på en kvarns blad eller av ångorna som andas ut från munnen i kallt klimat..

När det gäller de negativa miljöaspekterna observeras det också i den svarta röken från fordonens avgasrör, i rökkolonnerna i tornen i fabrikerna eller i röken som höjs när en skog brinner.
Du står också inför gasformiga fenomen när du ser ångor som kommer ut ur avloppet, i myrarna och kyrkogårdarna, i bubblan inuti akvariet, i heliumballongerna som släpps ut i himlen, i syret som växterna släpper ut som ett resultat av deras fotosyntes, och till och med i rapningar och flatulens.
Varhelst gaser observeras betyder att det skedde en kemisk reaktion, såvida de inte fixeras eller assimileras direkt från luften, den viktigaste källan till gaser (ytligt) på planeten. När temperaturen stiger kommer alla ämnen (kemiska element) att omvandlas till gaser, inklusive metaller som järn, guld och silver..
Oavsett gasernas kemiska natur, delar de alla gemensamt det stora avståndet som skiljer deras partiklar (atomer, molekyler, joner, etc.), som rör sig kaotiskt och godtyckligt genom en given volym eller ett givet utrymme..
Artikelindex
- 1 Egenskaper hos gaser
- 1.1 Fysisk
- 1.2 Elektrisk och värmeledningsförmåga
- 1.3 Reaktivitet
- 2 Gasernas beteende
- 3 Form av gaser
- 4 Tryck på en gas
- 4.1 Enheter
- 5 Volym av en gas
- 6 Huvudgaslagar
- 6.1 Boyles lag
- 6.2 Charles Law
- 6.3 Gay-Lussacs lag
- 6.4 Avogadros lag
- 7 Typer av gaser
- 7.1 Brännbara gaser
- 7.2 Industrigaser
- 7.3 Inerta gaser
- 8 Exempel på gasformiga ämnen och föreningar
- 8.1 Gasformiga föreningar
- 9 Referenser
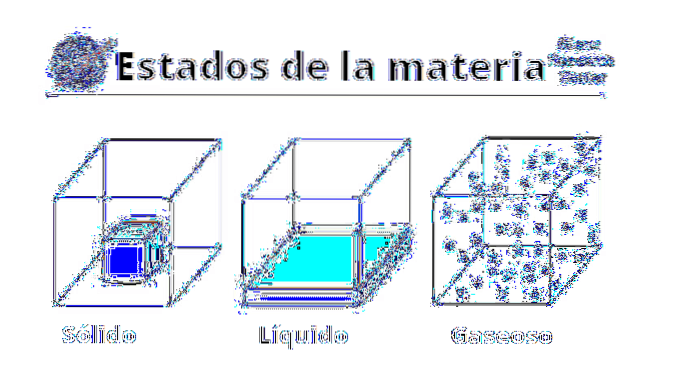
Egenskaper hos gaser
Fysisk
De fysiska egenskaperna hos gaser varierar beroende på vilken substans eller förening som är inblandad. Gaser är populärt associerade med dålig lukt eller förruttning, antingen på grund av svavelhalten eller på närvaron av flyktiga aminer. På samma sätt visualiseras de med grönaktiga, bruna eller gulaktiga färger, som skrämmer och ger ett dåligt tecken.
Men de flesta gaser, eller åtminstone de vanligaste, är faktiskt färglösa och luktfria. Även om de är svårfångade kan de kännas på huden och de motstår rörelse, till och med skapar viskösa lager på kropparna som passerar dem (som händer med flygplan)..
Alla gaser kan genomgå tryck- eller temperaturförändringar som slutligen förvandlar dem till respektive vätska. det vill säga de lider av kondens (om de kyls ned) eller kondens (om de "pressas").

Å andra sidan kan gaser lösa sig i vätskor och vissa porösa fasta ämnen (såsom aktivt kol). Bubblorna är resultatet av ansamlingar av gaser som ännu inte har lösts i mediet och flyr mot vätskeytan..
Elektrisk och värmeledningsförmåga
Under normala förhållanden (utan jonisering av partiklarna) är gaserna dåliga ledare för värme och elektricitet. Men när de är stressade med många elektroner låter de ström passera genom dem, vilket ses i blixtar under stormar..
Å andra sidan, vid låga tryck och utsätts för ett elektriskt fält, tänds vissa gaser, särskilt de ädla eller perfekta, och deras ljus används för att utforma reklam och nattaffischer (neonljus) såväl som i berömda elektriska urladdningslampor i gatlyktor.
När det gäller värmeledningsförmåga beter sig många gaser som värmeisolatorer, så deras införlivande i fyllning av fibrer, tyger eller glaspaneler hjälper till att förhindra att värme passerar genom dem och håller temperaturen konstant..
Det finns dock gaser som är bra värmeledare och kan orsaka värre brännskador än de som orsakas av vätskor eller fasta ämnen; till exempel som med het ånga från bakade muffins (eller empanadas) eller från ångstrålar som flyr från pannor.
Reaktivitet
I allmänhet klassificeras reaktioner som involverar gaser eller där de förekommer som farliga och besvärliga.
Deras reaktivitet beror återigen på deras kemiska natur; Men när man expanderar och mobiliserar med stor lätthet måste större försiktighet och kontroll utövas eftersom de kan utlösa drastiska tryckökningar som riskerar reaktorns struktur; för att inte tala om hur brandfarliga eller inte lyckliga gaser är.
Gasernas beteende
Makroskopiskt kan man få en uppfattning om gasernas beteende genom att bevittna hur rök, ringar eller cigaretternas litterära "tungor" utvecklas i luften. På samma sätt, när en rökgranat exploderar, är det intressant att detaljera rörelsen för dessa olika färgade moln.
Sådana observationer är emellertid föremål för luftens verkan och också för det faktum att det finns mycket fina fasta partiklar suspenderade i röken. Därför är dessa exempel inte tillräckliga för att nå en slutsats angående gasens sanna beteende. Istället har experiment utförts och den kinetiska teorin om gaser har utvecklats..
Molekylärt och idealiskt kolliderar gasformiga partiklar elastiskt med varandra med linjära, rotations- och vibrationsförskjutningar. De har en tillhörande genomsnittlig energi som gör att de kan resa fritt genom vilket utrymme som helst utan att nästan interagera eller kollidera med en annan partikel när volymen runt dem ökar..
Hans beteende skulle bli en blandning av den oregelbundna Brownian-rörelsen och kollisionerna mellan några biljardbollar som studsar oupphörligt mellan varandra och väggarna på bordet; om det inte finns några väggar kommer de att diffundera mot oändligheten, såvida de inte hålls tillbaka av en kraft: gravitation.
Form av gaser
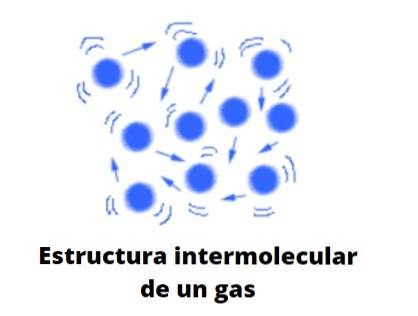
Gaser, till skillnad från vätskor och fasta ämnen, är inte fråga om den kondenserade typen; det vill säga att aggregeringen eller sammanhållningen av dess partiklar aldrig lyckas definiera en form. De delar med vätskor det faktum att de helt upptar volymen på behållaren som innehåller dem; emellertid saknar de yta och ytspänning.
Om gaskoncentrationen är hög kan dess ”tungor” eller de redan beskrivna makroskopiska formerna ses med blotta ögat. Dessa kommer förr eller senare att försvinna genom vindens verkan eller genom enbart expansion av gasen. Gaserna täcker därför alla hörn av det begränsade utrymmet med mycket homogena system.
Nu betraktar teorin bekvämt gaser som sfärer som knappast kolliderar med sig själva; men när de gör det studsar de elastiskt.
Dessa sfärer är mycket separerade från varandra, så gaserna är praktiskt taget "fulla" av vakuum; därav dess mångsidighet att passera genom den minsta slitsen eller sprickan, och det är lätt att komprimera dem avsevärt.
Det är därför, oavsett hur stängd en bageriinstallation är, om du går bredvid den är du säker på att du kommer att njuta av doften av nybakade bröd..
Tryck på en gas
Man kan tro att eftersom sfärerna eller partiklarna i gasen är så spridda och separerade, är de oförmögna att generera något tryck på kropparna eller föremålen. Men atmosfären visar att en sådan tro är falsk: den har massa, vikt och förhindrar att vätskor förångas eller kokar från ingenstans. Kokpunkterna mäts vid atmosfärstryck.
Gastrycket blir mätbart om manometrar finns tillgängliga eller om de är inneslutna i behållare med icke-deformerbara väggar. Ju fler gaspartiklar det finns inne i behållaren, desto större är antalet kollisioner mellan dem och behållarens väggar..
När de kolliderar med väggarna pressar dessa partiklar dem, eftersom de utövar en kraft som är proportionell mot sin kinetiska energi på ytan. Det är som om de ideala biljardbollarna kastades mot en vägg; om det finns många som påverkar dem i hög hastighet kan det till och med gå sönder.
Enheter
Det finns många enheter som åtföljer gastrycksmätningar. Några av de mest kända är millimeter kvicksilver (mmHg), som torr. Det finns de i det internationella enhetssystemet (SI) som definierar pascal (Pa) i termer av N / mtvå; och av honom, kilo (kPa), mega (MPa) och giga (GPa) pascal.
Volym av en gas
En gas upptar och expanderar genom hela behållarens volym. Ju större behållaren är, kommer gasvolymen att vara för; men både dess tryck och densitet kommer att minska för samma mängd partiklar.
Själva gasen har däremot en tillhörande volym som inte beror så mycket på dess natur eller molekylära struktur (helst) utan på de tryck- och temperaturförhållanden som styr den; detta är dess molära volym.
I verkligheten varierar molvolymen från en gas till en annan, även om variationerna är små om de inte är stora och heterogena molekyler. Till exempel molvolymen av ammoniak (NH3, 22 079 L / mol) vid 0 ºC och 1 atm, skiljer sig från helium (He, 22 435 L / mol).
Alla gaser har en molvolym som förändras som en funktion av P och T, och oavsett hur stora deras partiklar är, är antalet av dem alltid detsamma. Härifrån härledde han faktiskt det som är känt av Avogadros nummer (NTILL).
Huvudsakliga gaslagar
Gasernas beteende har studerats i århundraden genom experiment, djupgående observationer och tolkning av resultaten..
Sådana experiment gjorde det möjligt att upprätta en serie lagar som, tillsammans i samma ekvation (den för ideala gaser), hjälper till att förutsäga reaktionerna från en gas till olika tryck- och temperaturförhållanden. På detta sätt finns det ett samband mellan dess volym, temperatur och tryck, liksom antalet mol i ett givet system..
Bland dessa lagar finns följande fyra: Boyle, Charles, Gay-Lussac och Avogadro's.
Boyles lag
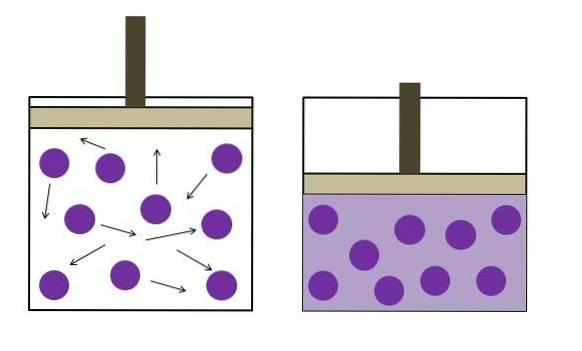
Boyles lag säger att vid konstant temperatur är volymen för en idealgas omvänd proportionell mot dess tryck; ju större behållare desto lägre tryck kommer väggarna att uppleva på grund av samma mängd gas..
Charles Law

Charles lag säger att vid konstant tryck är volymen på en idealgas direkt proportionell mot dess temperatur. Ballonger visar Charles lag, för om de värms upp blåser de upp lite mer, medan de sänks ned i flytande kväve tappar de ut eftersom gasvolymen i dem dras samman..
Gay-Lussac-lag
Gay-Lussacs lag säger att vid konstant volym är trycket från en idealgas direkt proportionellt mot dess temperatur. Om en gas värms upp i en välstängd gryta kommer trycket inuti att bli större varje gång grytans väggar deformeras eller expanderar; det vill säga, dess volym ändras inte, den är konstant.
Avogadros lag
Slutligen säger Avogadros lag att volymen som upptas av en idealgas är direkt proportionell mot antalet partiklar. Således, om vi har en mol partiklar (6.02 · 102. 3) kommer vi då ha gasens molära volym.
Typer av gaser
Brännbara gaser
De är de gaser vars komponenter fungerar som bränslen, eftersom de används för produktion av termisk energi. Några av dem är naturgas, flytande petroleumgas och väte.
Industriella gaser
Det är de tillverkade gaserna som marknadsförs för allmänheten för olika användningsområden och applikationer, till exempel för hälso-, livsmedels-, miljöskydd, metallurgi, kemisk industri, säkerhetssektorer. Några av dessa gaser är bland annat syre, kväve, helium, klor, väte, kolmonoxid, propan, metan, dikväveoxid..
Inerta gaser
De är de gaser som under specifika temperatur- och tryckförhållanden inte genererar någon kemisk reaktion eller mycket låg reaktion. De är neon, argon, helium, krypton och xenon. De används i kemiska processer där icke-reaktiva element är nödvändiga.
Exempel på gasformiga element och föreningar
Vilka är de gasformiga elementen i det periodiska systemet under jordförhållanden?
Vi har först väte (H), som bildar H-molekylertvå. Helium (He), den lättaste ädelgasen, följer; och sedan kväve (N), syre (O) och fluor (F). Dessa sista tre bildar också diatomiska molekyler: Ntvå, ELLERtvå och Ftvå.
Efter fluor kommer neon (Ne), ädelgasen som följer helium. Nedanför fluor har vi klor (Cl), i form av Cl-molekylertvå.
Därefter har vi resten av ädelgaserna: argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) och oganeson (Og).
Därför är de totalt tolv gasformiga element; elva om vi utesluter den mycket radioaktiva och instabila oganesonen.
Gasformiga föreningar
Förutom gasformiga ämnen kommer några vanliga gasformiga föreningar att listas:
-HtvåJa, vätesulfid, ansvarig för lukten av ruttna ägg
-NH3, ammoniak, den skarpa aromen som finns i använda tvålar
-COtvå, koldioxid, en växthusgas
-INTEtvå, kvävedioxid
-NEJ, kväveoxid, en gas som tros vara mycket giftig men spelar en viktig roll i cirkulationssystemet
-SW3, svaveltrioxid
-C4H10, butan
-HCl, väteklorid
-ELLER3, ozon
-SF6, svavelhexafluorid
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Egenskaperna hos gaser. Återställd från: chemed.chem.purdue.edu
- Wikipedia. (2019). Gas. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5 december 2018). Gaser - Allmänna egenskaper hos gaser. Återställd från: thoughtco.com
- Harvard Men's Health Watch. (2019). Gasens tillstånd. Återställd från: health.harvard.edu
- Redaktörer för kylning av elektronik. (1 september 1998). Gasens värmeledningsförmåga. Återställd från: electronics-cooling.com



Ingen har kommenterat den här artikeln än.