
Glykoproteinsstruktur, funktioner, klasser och exempel
De glykoproteiner eller glykoproteiner är transmembranproteiner som ingår i den stora familjen av membranglykokonjugat och finns i djur, växter och mikroorganismer såsom bakterier, jäst och archaea.
De definierades för första gången 1908 av Protein Nomenclature Committee från American Society of Biochemists och är resultatet av glykosidförening av ett protein med en kolhydratdel som kallas glukan..
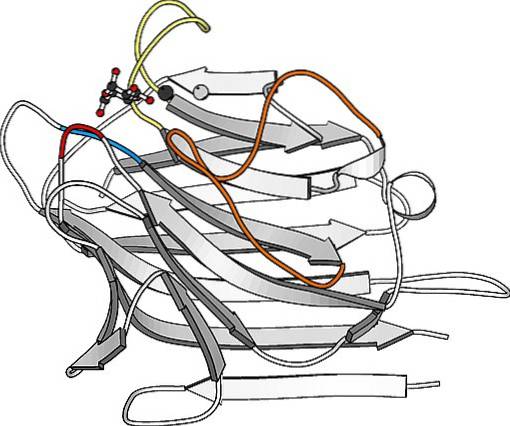
De är proteiner som är särskilt rikliga på ytan av plasmamembranet i många celler och utgör en viktig del av kolhydratskiktet som täcker dem och som i många fall kallas glukokalyx..
Prekursorproteinerna för glykoproteinerna modifieras kovalent i det endoplasmiska retikulumet och Golgi-komplexet hos många eukaryoter efter deras översättning, även om det också finns fall av glykosylering i cytosolen, men de är mindre vanliga och förekommer endast med en.
Proteinglykosylering har ofta viktiga funktionella effekter på dess aktivitet, eftersom det kan delta i vikning och därmed i upprättandet av dess tertiära struktur.
Glykaner har flera biologiskt viktiga funktioner för cellen, eftersom de kan ge celler specificitet och delta i intracellulära och intercellulära signalprocesser, eftersom de är ligander för endogena och exogena receptorer.
Glykoproteiner, liksom resten av glykokonjugaten, är så viktiga att en cell ägnar upp till 1% av sitt genom till glykosyleringsmaskineriet och hos människor modifieras mer än 70% av proteinerna genom glykosylering.
Artikelindex
- 1 Struktur
- 2 funktioner
- 2.1 Strukturell
- 2.2 Celligenkänning
- 2.3 Cellvidhäftning
- 2.4 Glykoproteiner som terapeutiska mål
- 3 klasser
- 4 Exempel
- 5 Referenser
Strukturera
Strukturen av glykoproteiner studeras baserat på deras aminosyrasekvens, glykosyleringsställena i sekvensen och strukturerna för glykandelarna som binder vid dessa ställen..
Oligosackaridkedjorna som är kopplade genom glykosylering till dessa proteiner är i allmänhet mycket olika, men de är korta, eftersom de inte överstiger 15 sockerrester. Vissa proteiner har en enda oligosackaridkedja, men andra kan ha mer än en och dessa kan vara grenade.
Föreningen mellan oligosackarider och proteiner sker genom det anomera kolet i kolhydraten och hydroxylgruppen (-OH) i en serin- eller treoninrest i fallet med ELLER-glykosylering, eller genom amidkvävet i en asparaginrest, i fallet med N-glykosylering.
På så sätt bundna kolhydrater kan representera upp till 70% av ett glykoproteins molekylvikt och egenskaperna hos kolhydratdelen (storlek och laddning, till exempel) kan skydda vissa proteiner mot enzymatisk proteolys..
Samma protein kan ha, i olika vävnader, olika glykosyleringsmönster som gör det till ett annat glykoprotein, eftersom den fullständiga strukturen inte bara innehåller aminosyraresterna och deras rumsliga arrangemang utan också oligosackariderna fästa vid dem..
Bland de sockerrester som upprepade gånger finns i glykoproteiner är: D-galaktos, D-mannos, D-glukos, L-fukos, D-xylos, L-arabinofuranos, N-acetyl-D-glukosamin, N-acetyl-D- galaktosamin, några sialinsyror och modifieringar av alla dessa.
Funktioner
Strukturell
Ur strukturell synpunkt ger glykoproteiner kolhydratkedjor som deltar i skyddet och smörjningen av celler, eftersom de kan hydratisera och bilda en viskös substans som motstår mekaniska och kemiska aggressioner.
Vissa glykoproteiner finns också i bakterier och archaea och dessa är viktiga komponenter i S-skiktet, som är det yttersta skiktet av cellöverdraget..
Dessutom finns de också som beståndsdelar av flagellinproteiner, som är en del av de flagellära filamenten som används som rörelseorgan..
Växter har också strukturella glykoproteiner som kännetecknas av komplexa glykosyleringsmönster och som kan hittas som en del av cellväggsstrukturen eller i den extracellulära matrisen..
Celligenkänning
Glykoproteiner har viktiga funktioner som igenkänningsställen mellan celler, eftersom många receptorer på cellytan kan känna igen specifika oligosackaridsekvenser.
Ett exempel på intercellulära igenkänning som sker genom oligosackaridkedjorna på cellytan är fallet med igenkänningen mellan ägglossningen och spermierna, vilket är nödvändigt för att befruktningsfenomenet ska inträffa i flercelliga organismer med sexuell reproduktion..
Blodgrupper hos människor bestäms av identiteten på sockerarterna fästa vid glykoproteinerna som specificerar dem. Antikroppar och många hormoner är också glykoproteiner och deras funktioner är väsentliga för kroppens signalering och försvar.
Cellvidhäftning
T-cellerna i däggdjursimmunsystemet har ett glykoprotein med vidhäftningsdomäner som kallas CD2, vilket är en nyckelkomponent för immunstimulering eftersom det förmedlar bindningen mellan lymfocyten och antigenpresenterande celler genom dess receptor, CD58-glykoproteinet..
Vissa virus som har viktiga patogena funktioner för många däggdjur, inklusive människor, har ytglykoproteiner som fungerar vid vidhäftningsprocesserna hos viruspartiklarna till cellerna de parasiterar..
Så är fallet med GP120-proteinet från det humana förvärvade immunbristviruset eller HIV, som interagerar med ett ytprotein från humana celler känt som GP41 och som samarbetar med inträde av viruset i cellen..
På samma sätt deltar många glykosylerade proteiner i viktiga celladhesionsprocesser som äger rum i det vanliga livet för celler som finns i många vävnader i multicellulära organismer..
Glykoproteiner som terapeutiska mål
Dessa protein-kolhydratkomplex är de föredragna målen för många patogener såsom parasiter och virus, och många glykoproteiner med avvikande glykosyleringsmönster har kritiska roller i autoimmuna sjukdomar och cancer..
Av dessa skäl har olika forskare tagit på sig uppgiften att föreslå dessa proteiner som möjliga terapeutiska mål och för design av diagnostiska metoder, ny generationsterapier och till och med för design av vacciner..
Lektioner
Klassificeringen av glykoproteiner baseras huvudsakligen på naturen hos den glykosidbindning som förenar protein- och kolhydratdelarna och på egenskaperna hos de länkade glykanerna..
Enligt sockerresterna kan det finnas glykoproteiner med monosackarider, disackarider, oligosackarider, polysackarider och derivat av dessa. Vissa författare anser en klassificering av glykoproteiner i:
- Proteoglykaner, som är en underklass inom gruppen glykoproteiner som i kolhydratdelen innehåller polysackarider som huvudsakligen består av aminosockerarter (glykosaminoglykaner).
- Glykopeptider, vilka är molekyler som består av kolhydrater kopplade till oligopeptider som består av aminosyror i deras L- och / eller D-konformationer.
- Glyko-aminosyror, som är aminosyror kopplade till en sackarid genom vilken typ av kovalent bindning som helst.
- Glykosylaminosyror, vilka är aminosyror bundna till en sackariddel genom O-, N- eller S-glykosidbindningar.
I nomenklaturen för dessa proteiner, sålunda kopplade till kolhydrater, används prefixen O-, N- och S- för att specificera genom vilka bindningar sockerarterna är bundna till polypeptidkedjan..
Exempel
- Glykoforin A är ett av de bäst studerade glykoproteinerna: det är ett integrerat protein i erytrocytmembranet (celler eller röda blodkroppar) och har 15 oligosackaridkedjor kovalent kopplade till aminosyrarester i den N-terminala regionen genom länkar ELLER-glykosidika och en kedja kopplad av en bindning N-glykosid.
- De flesta proteinerna i blodet är glykoproteiner och denna grupp innehåller immunglobuliner och många hormoner.
- Laktalbumin, ett protein som finns i mjölk glykosyleras, liksom många bukspottkörtel- och lysosomala proteiner.
- Lektiner är kolhydratbindande proteiner och har därför flera funktioner i igenkänning.
- Vi måste också lyfta fram många djurhormoner som är glykoproteiner. Bland dessa kan nämnas lutropin (LH), follitropin (FSH) och tyrotropin (TSH), som syntetiseras i den främre hypofysen och koriongonadotropin som produceras i moderkakan hos människor, primater och hästdjur..
Dessa hormoner har reproduktionsfunktioner då LH stimulerar steroidogenes i äggstockarna och testikel Leydig-celler..
- Kollagen, ett rikligt protein som huvudsakligen finns i bindväv hos djur, representerar en enorm familj av glykoproteiner som består av mer än 15 typer av proteiner som, även om de har många gemensamma egenskaper, är helt olika.
Dessa proteiner innehåller "icke-kollagena" portioner, varav några består av kolhydrater..
- Extensiner är växtproteiner som består av ett nätverk av olösliga glykoproteiner som är rika på hydroxiprolin och serinrester. De finns i väggen till växtceller och anses fungera som ett försvar mot olika typer av stress och patogener..
- Växter har också lektinliknande proteiner och ett speciellt exempel på dessa är potatislektiner, som uppenbarligen har förmågan att agglutinera blodceller såsom erytrocyter..
- Sist men inte minst kan slemhinnor nämnas, vilka är glykoproteiner som utsöndras i slemhinnan och är en del av saliv hos djur, som uppfyller smörjnings- och signalfunktioner, främst.
Referenser
- Montreuil, J., Vliegenthart, J., & Schachter, H. (1995). Glykoproteiner. (A. Neuberger & L. Deenen, red.). Elsevier.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principer för biokemi. Omega-utgåvor (5: e upplagan). https://doi.org/10.1007/s13398-014-0173-7.2
- Struwe, W., & Cosgrave, E. (2011). Funktionell och strukturell proteomik av glykoproteiner. (R. Owens & J. Nettleship, red.). London: Springer.
- Voet, D., & Voet, J. (2006). Biokemi (3: e upplagan). Panamerikansk medicinsk ledare.
- Wittman, V. (2007). Glykopeptider och glykoproteiner. Syntes, struktur och tillämpning. (V. Balzani, J.-M. Lehn, A. de Meijere, S. Ley, K. Houk, S. Schreiber, J. Thiem, red.). Leipzig: Springer Science + Business Media, LLC.


Ingen har kommenterat den här artikeln än.