
Proteinglykosyleringstyper, process och funktioner

De proteinglykosylering Det är en post-translationell modifiering som består av tillsatsen av linjära eller grenade oligosackaridkedjor till ett protein. De resulterande glykoproteinerna är i allmänhet ytproteiner och sekretoriska vägproteiner..
Glykosylering är en av de vanligaste peptidmodifikationerna bland eukaryota organismer, men det har visat sig att det förekommer även i vissa arter av archaea och bakterier..
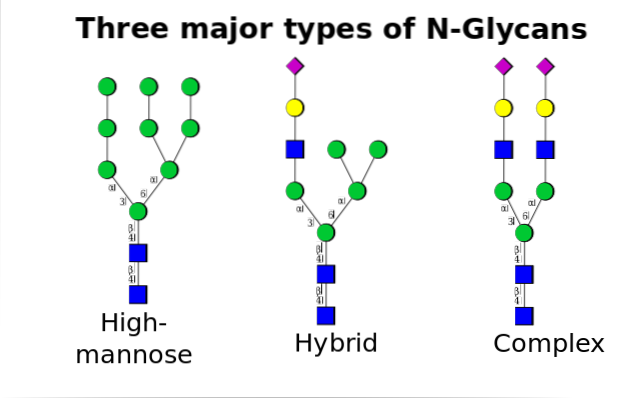
I eukaryoter inträffar denna mekanism mellan endoplasmatisk retikulum (ER) och Golgi-komplexet, med ingripande av olika enzymer involverade både i regleringsprocesser och i bildandet av kovalenta bindningar med protein + oligosackarid..
Artikelindex
- 1 Typer av glykolys
- 1.1 N-glykosylering
- 1.2 O-glykosylering
- 1.3 C-mannosylering
- 1.4 Glypiering (från engelska "Glypiation")
- 2 Process
- 2.1 I eukaryoter
- 2.2 I prokaryoter
- 3 funktioner
- 3.1 Betydelse
- 4 Referenser
Typer av glykolys
Beroende på bindningsstället för oligosackariden till proteinet kan glykosylering klassificeras i fyra typer:
N-glykosylering
Det är det vanligaste av alla och inträffar när oligosackarider binder till kvävet i amidgruppen av asparaginrester i Asn-X-Ser / Thr-motivet, där X kan vara vilken aminosyra som helst utom prolin.
ELLER-glykosylering
När kolhydrater är bundna till hydroxylgruppen av serin, treonin, hydroxylysin eller tyrosin. Det är en mindre vanlig modifiering och är exempel på proteiner som kollagen, glykoforin och muciner..
C-mannosilation
Den består av tillsatsen av en mannosrest som binder till proteinet genom en C-C-bindning med C2 i indolgruppen i tryptofanrester.
Glipiering (från engelska “Glypiering ")
En polysackarid fungerar som en brygga för att fästa ett protein till ett glykosylfosfatidylinositol (GPI) ankare på membranet.
Bearbeta
I eukaryoter
De N-glykosylering är den som har studerats mer detaljerat. I däggdjursceller börjar processen i den grova ER, där en förformad polysackarid binder till proteiner när de kommer ut från ribosomer..
Nämnda föregångarpolysackarid består av 14 sockerrester, nämligen: 3 glukos (Glc), 9 mannos (Man) och 2 N-acetylglukosamin (GlcNAc) -rester.
Denna föregångare är vanlig hos växter, djur och encelliga eukaryota organismer. Det är bundet till membranet tack vare en bindning med en dolikolmolekyl, en isoprenoidlipid inbäddad i ER-membranet..
Efter dess syntes överförs oligosackariden av oligosakryltransferas-enzymkomplexet till en asparaginrest inkluderad i tri-peptidsekvensen Asn-X-Ser / Thr av ett protein medan det översätts.
De tre Glc-resterna i slutet av oligosackariden tjänar som en signal för korrekt oligosackaridsyntes och klyvs tillsammans med en av Man-resterna innan proteinet bärs in i Golgi-apparaten för vidare bearbetning..
En gång i Golgi-apparaten kan oligosackariddelarna fästa till glykoproteinerna modifieras genom tillsats av galaktos, sialinsyra, fukos och många andra rester, vilket ger kedjor av mycket större variation och komplexitet..
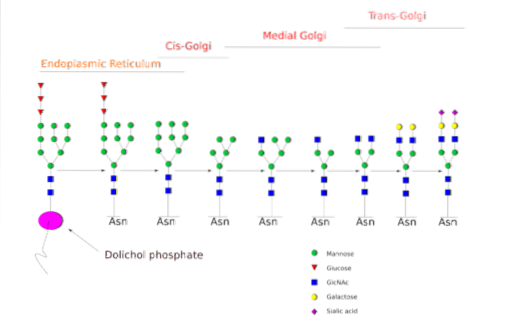
Det enzymatiska maskineriet som behövs för att utföra glykosyleringsprocesserna innefattar ett flertal glykosyltransferaser för tillsats av sockerarter, glykosidas för avlägsnande av dem och olika nukleotidsockertransportörer för bidraget från de rester som används som substrat..
I prokaryoter
Bakterier har inte intracellulära membransystem, så bildandet av den initiala oligosackariden (av endast 7 rester) sker på den cytosoliska sidan av plasmamembranet..
Nämnda föregångare syntetiseras på en lipid som sedan translokeras av ett ATP-beroende flipas till det periplasmiska utrymmet, där glykosylering sker..
En annan viktig skillnad mellan eukaryot och prokaryot glykosylering är att enzymet oligosackaridtransferas (oligosacaryltransferas) från bakterier kan överföra sockerrester till fria delar av redan vikta proteiner, inte som de översätts av ribosomer..
Vidare är peptidmotivet som känns igen av detta enzym inte samma eukaryota tri-peptidsekvens..
Funktioner
De N-oligosackarider bundna till glykoproteiner tjänar olika syften. Till exempel, vissa proteiner kräver denna post-translationella modifiering för att uppnå korrekt vikning av deras struktur..
För andra ger det stabilitet, antingen genom att undvika proteolytisk nedbrytning eller för att denna del är nödvändig för att de ska kunna fullgöra sin biologiska funktion..
Eftersom oligosackarider har en stark hydrofil karaktär, ändrar deras kovalenta tillsats till ett protein nödvändigtvis dess polaritet och löslighet, vilket kan ha relevans ur funktionell synvinkel..
När de är fästa vid membranproteiner är oligosackarider värdefulla informationsbärare. De deltar i processerna för signalering, kommunikation, igenkänning, migration och celladhesion.
De har en viktig roll i blodkoagulering, läkning och immunsvar, liksom vid bearbetning av proteinkvalitetskontroll, vilket är glykanberoende och oumbärligt för cellen..
Betydelse
Minst 18 genetiska sjukdomar har kopplats till proteinglykosylering hos människor, varav några involverar dålig fysisk och mental utveckling, medan andra kan vara dödliga.
Det finns ett växande antal upptäckter relaterade till glykosyleringssjukdomar, särskilt hos barn. Många av dessa störningar är medfödda och har att göra med defekter associerade med de initiala stadierna av oligosackaridbildning eller med reglering av enzymer som deltar i dessa processer..
Eftersom en stor del av de glykosylerade proteinerna utgör glykokalyxen, finns det ett växande intresse för att verifiera att mutationer eller förändringar i glykosyleringsprocesserna kan relateras till förändringen i mikromiljön hos tumörceller och därmed främja utvecklingen av tumörer och utveckling av metastaser hos cancerpatienter.
Referenser
- Aebi, M. (2013). N-kopplat proteinglykosylering i ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Proteinglykosylering vid utveckling och sjukdom. BioEssays, tjugoett(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Molekylär cellbiologi (5: e upplagan). Freeman, W. H. & Company.
- Luckey, M. (2008). Membranstrukturbiologi: med biokemiska och biofysiska fundament. Cambridge University Press. Hämtad från www.cambrudge.org/9780521856553
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principer för biokemi. Omega-utgåvor (5: e upplagan).
- Nothaft, H., & Szymanski, C. M. (2010). Proteinglykosylering i bakterier: Sötare än någonsin. Naturrecensioner Mikrobiologi, 8(11), 765-778.
- Ohtsubo, K., & Marth, J. D. (2006). Glykosylering i cellulära mekanismer för hälsa och sjukdom. Cell, 126(5), 855-867.
- Spiro, R. G. (2002). Proteinglykosylering: natur, distribution, enzymatisk bildning och sjukdomseffekter av glykopeptidbindningar. Glykobiologi, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Proteinglykosylering i cancer. Årlig översyn av patologi: mekanismer för sjukdom, 10(1), 473-510.
- Strasser, R. (2016). Växtprotein glykosylering. Glykobiologi, 26(9), 926-939.
- Xu, C., & Ng, D. T. W. (2015). Glykosyleringsstyrd kvalitetskontroll av proteinvikning. Naturrecensioner Molekylär cellbiologi, 16(12), 742-752.
- Zhang, X., & Wang, Y. (2016). Glykosyleringskvalitetskontroll med Golgi-strukturen. Journal of Molecular Biology, 428(16), 3183-3193.



Ingen har kommenterat den här artikeln än.