
Hydroxyl (OH) struktur, jon och funktionella grupper

De hydroxylgrupp (ÅH) Det är en som har en syreatom och liknar en vattenmolekyl. Det kan hittas som en grupp, en jon eller en radikal (OH·). I en värld av organisk kemi bildar den en väsentligen bindning med kolatomen, även om den också kan göra det med svavel eller fosfor.
Å andra sidan deltar den i oorganisk kemi som en hydroxyljon (närmare bestämt hydroxid eller hydroxyljon). Det vill säga typen av bindning mellan den och metallerna är inte kovalent utan jonisk eller koordinerande. På grund av detta är det en mycket viktig "karaktär" som definierar egenskaperna och transformationerna hos många föreningar..

Som framgår av bilden ovan är OH-gruppen kopplad till en radikal betecknad med bokstaven R (om den är alkyl) eller med bokstaven Ar (om den är aromatisk). För att inte skilja mellan de två representeras det ibland kopplat till en "våg". Beroende på vad som ligger bakom den "vågen" talar vi alltså om en organisk förening eller en annan..
Vad bidrar OH-gruppen till den molekyl som den binder till? Svaret ligger i deras protoner, som kan "ryckas upp" av starka baser för att bilda salter; de kan också interagera med andra omgivande grupper genom vätebindningar. Oavsett var den är representerar den en potentiell vattenbildande region.
Artikelindex
- 1 Struktur
- 1.1 Vätebroar
- 2 Hydroxyljon
- 3 uttorkningsreaktion
- 4 Funktionella grupper
- 4.1 Alkoholer
- 4.2 Fenoler
- 4.3 Karboxylsyror
- 5 Referenser
Strukturera
Vad är hydroxylgruppens struktur? Vattenmolekylen är vinklad; det vill säga det ser ut som en Bumerang. Om de "skär" en av dess ändar - eller vad som är samma, ta bort ett proton - två situationer kan uppstå: radikalen (OH·eller hydroxyljonen (OH-). Båda har dock en molekylär linjär geometri (men inte elektronisk).
Uppenbarligen beror detta på det faktum att de enkla bindningarna orienterar två atomer för att hålla sig i linje, men detsamma händer inte med deras hybridorbitaler (enligt valensbindningsteorin).
Å andra sidan, eftersom vattenmolekylen är H-O-H och att veta att den är vinkel, kommer H-R för att förändra R eller Ar från R-O-H eller Ar-O-H. Här har den exakta regionen som involverar de tre atomerna vinkelmolekylär geometri, men den för de två O-H-atomerna är linjär..
Vätebindningar
OH-gruppen tillåter molekylerna som har den att interagera med varandra genom vätebindningar. De är i sig inte starka, men när antalet OH ökar i strukturen hos föreningen multipliceras deras effekter och återspeglas i föreningens fysikaliska egenskaper..
Eftersom dessa broar kräver att deras atomer vetter mot varandra måste syreatomen i en OH-grupp bilda en rak linje med vätgas i en andra grupp..
Detta ger upphov till mycket specifika rumsliga arrangemang, såsom de som finns inom strukturen för DNA-molekylen (mellan kvävebaser)..
På samma sätt är antalet OH-grupper i en struktur direkt proportionell mot vattnets affinitet för molekylen eller vice versa. Vad betyder det? Till exempel gör socker, även om det har en hydrofob kolstruktur, det stora antalet OH-grupper det mycket lösligt i vatten..
I vissa fasta ämnen är emellertid intermolekylära interaktioner så starka att de "föredrar" att hålla ihop snarare än att lösa sig i ett visst lösningsmedel..
Hydroxyljon
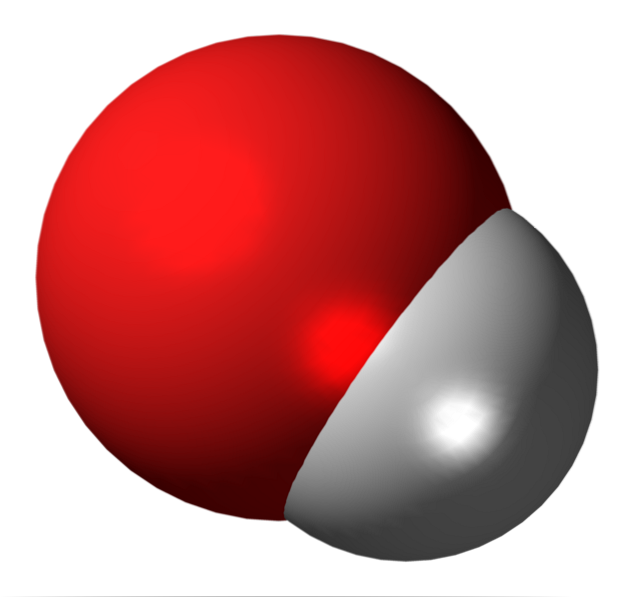
Även om jonen och hydroxylgruppen är mycket lika, är deras kemiska egenskaper mycket olika. Hydroxyljonen är en extremt stark bas; det vill säga det accepterar protoner, även av krafter, för att bli vatten.
Varför? Eftersom det är en ofullständig vattenmolekyl, negativt laddad och ivrig att komplettera med tillsats av en proton.
En typisk reaktion för att förklara grundläggningen av denna jon är följande:
R-OH + OH- => R-O- + HtvåELLER
Detta inträffar när en baslösning tillsätts till en alkohol. Här är alkoxidjonen (RO-) associeras omedelbart med en positiv jon i lösning; det vill säga Na-katjonen+ (Sårskorpa).
Eftersom OH-gruppen inte behöver protoneras är den en extremt svag bas, men som kan ses i den kemiska ekvationen kan den donera protoner, men endast med mycket starka baser..
Likaså är det värt att nämna den nukleofila naturen hos OH-. Vad betyder det? Eftersom det är en mycket liten negativ jon, kan den resa snabbt för att attackera positiva kärnor (inte atomkärnor).
Dessa positiva kärnor är atomer i en molekyl som lider av en elektronisk brist på grund av sin elektronegativa miljö..
Dehydrering reaktion
OH-gruppen accepterar endast protoner i mycket sura medier, vilket leder till följande reaktion:
R-OH + H+ => R-OtvåH+
I detta uttryck H+ är en sur proton donerad av en mycket sur art (HtvåSW4, HCl, HI, etc.). Här bildas en vattenmolekyl, men den är kopplad till resten av den organiska (eller oorganiska) strukturen.
Den positiva partiladdningen på syreatomen orsakar försvagningen av R-O-bindningentvåH+, vilket resulterar i utsläpp av vatten. Av denna anledning är det känt som en uttorkningsreaktion, eftersom alkoholer i sura medier släpper ut flytande vatten..
Vad kommer härnäst? Bildandet av så kallade alkener (RtvåC = CRtvå eller RtvåC = CHtvå).
Funktionella grupper
Alkoholer
Hydroxylgruppen i sig är redan en funktionell grupp: alkoholerna. Exempel på denna typ av förening är etylalkohol (EtOH) och propanol (CH3CHtvåCHtvåÅH).
De är i allmänhet blandbara vätskor med vatten eftersom de kan bilda vätebindningar mellan sina molekyler.
Fenoler
En annan typ av alkoholer är aromater (ArOH). Ar betecknar en arylradikal, som inte är mer än en bensenring med eller utan alkylsubstituenter.
Aromatisiteten hos dessa alkoholer gör dem resistenta mot syraprotonattacker; med andra ord kan de inte torkas ut (så länge OH-gruppen är direkt fäst vid ringen).
Detta är fallet med fenol (C6H5ÅH):
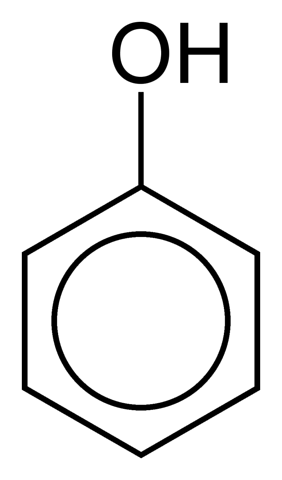
Fenolringen kan vara en del av en större struktur, som i aminosyran tyrosin.
Karboxylsyror
Slutligen utgör hydroxylgruppen syrakaraktären hos karboxylgruppen närvarande i organiska syror (-COOH). Här, till skillnad från alkoholer eller fenoler, är OH mycket surt, dess proton doneras till starka eller något starka baser..
Referenser
- Helmenstine, Anne Marie, Ph.D. (7 februari 2017). Definition av Hydroxyl Group. Hämtad från: thoughtco.com
- Wikipedia. (2018). Hydroxigrupp. Hämtad från: en.wikipedia.org
- Biologiprojektet. (25 augusti 2003). Hydroxylaminosyror. Institutionen för biokemi och molekylär biofysik University of Arizona. Hämtad från: biology.arizona.edu
- Dr. J.A. Colapret. Alkoholer. Hämtad från: colapret.cm.utexas.edu
- Quimicas.net (2018). Hydroxyl-gruppen. Återställd från: quimicas.net
- Dr. Ian Hunt. Dehydrering av alkoholer. Institutionen för kemi, University of Calgary. Hämtad från: chem.ucalgary.ca


Ingen har kommenterat den här artikeln än.