
Kalciumhydrid (CaH2) egenskaper, reaktivitet och användningsområden

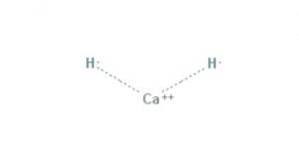
De kalciumhydrid Det är en kemisk förening med formeln CaH2, vilket gör den till en alkalisk jordhydrid. Denna kemiska förening har två jonbindningar mellan kalcium och de två hydridjonerna, som visas i figur 1.
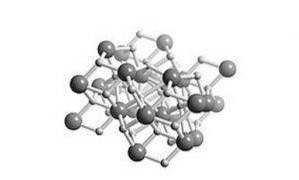
Det är en saltlösning, vilket innebär att dess struktur liknar salt. Dess kristallina struktur är densamma som den för blyklorid (cotunnite mineral) som visas i figur 2.
Alla alkali- och jordalkalimetaller bildar hydridsalter. I kemi är en hydrid anjonen av väte, H- eller, mer vanligt, är det en förening i vilken ett eller flera vätecentra har nukleofila, reducerande eller basiska egenskaper.
I föreningar som anses hydrider är väteatomen bunden till ett mer elektropositivt element eller en grupp.
Det kan produceras genom att reagera kalcium och väte vid en temperatur mellan 300 och 400 grader Celsius. Ett annat sätt att bereda kalciumhydrid är att värma kalciumklorid tillsammans med väte och metalliskt natrium. Reaktionen sker enligt följande:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
I denna reaktion skapar kalcium (Ca) och väte (H) en molekyl kalciumhydrid medan natriumatomer tillsammans med klor skapar natriumkloridmolekyler (NaCl)..
Kalciumhydrid kan också produceras genom att reducera kalciumoxid (CaO) med magnesium (Mg). Reaktionen utförs i närvaro av väte. Denna reaktion ger också magnesiumoxid (MgO). Nedan följer formeln för denna kemiska reaktion:
CaO + Mg + H2 → CaH2 + MgO
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos kalciumhydrid
- 2 Reaktivitet och faror
- 3 Hantering och lagring
- 4 Användningar och applikationer
- 4.1 Torkmedel
- 4.2 Väteproduktion
- 4.3 Reduktionsmedel
- 5 Nackdel med användningen av kalciumhydrid
- 6 Referenser
Fysikaliska och kemiska egenskaper hos kalciumhydrid
Kalciumhydrid är en uppsättning kristaller med en ortorombisk struktur i vit färg när den är ren. I allmänhet är det sällsynt att hitta det i denna form så det har vanligtvis en grå nyans. Det saknar en karakteristisk lukt. Dess utseende visas i figur 3 (Royal Society of Chemistry, 2015).

Den har en molekylvikt på 42,094 g / mol, har en smältpunkt på 816 grader Celsius och en densitet på 1,70 g / ml. Om det löser sig i vatten reagerar det våldsamt och producerar väte. Reagerar också med alkohol (National Center for Biotechnology Information., S.F.).
Reaktivitet och faror
Kalciumhydrid är en stabil kemikalie, även om den är mycket reaktiv mot vatten eller fukt. I kontakt med vatten släpper det ut brandfarliga vätgaser som kan antändas spontant.
Det anses vara en explosiv förening. Vid upphettning i reaktion med tetrahydrofuran kan det orsaka en explosion. När det blandas med klorat, hypoklorit, bromat, kaliumperklorat blir det känsligt för värme, friktion och blir explosivt (Kalciumhydrid 7789-78-8, 2016).
När silverfluorid krossas med kalciumhydrid blir massan glödande. Stark uppvärmning av hydrid med klor, brom eller jod leder till glöd.
Blandningar av hydrid med olika bromater, exempelvis bariumbromat eller klorater, exempelvis bariumklorat och perklorater såsom kaliumperklorat, exploderar vid malning. CaH2 reagerar glödande med silverfluorid om det utsätts för friktion.
Denna förening måste hanteras under en inert atmosfär. Om det inte hanteras ordentligt kan det utgöra ett allvarligt hot mot laboratoriets personal, förstahandsinspektörer och kemiskt avfallshanterare (UC-centrum för laboratoriesäkerhet, 2013).
Extremt farligt vid kontakt med huden eller ögonen, eftersom det är irriterande. Mycket farligt vid hudkontakt eftersom det kan vara frätande.
Det är också farligt vid förtäring och inandning. Mängden vävnadsskada beror på kontaktens längd. Kontakt med ögonen kan leda till hornhinneskador eller blindhet..
Kontakt med huden kan orsaka inflammation och blåsor. Inandning av damm kommer att orsaka irritation i mag-tarmkanalen eller luftvägarna, som kännetecknas av sveda, nysningar och hosta..
Allvarlig överexponering kan leda till lungskador, kvävning, medvetslöshet och till och med dödsfall. Inflammation i ögat kännetecknas av rodnad, vattning och klåda. Inflammation i huden kännetecknas av klåda, skalning, rodnad eller ibland blåsor.
Upprepad låg exponering för ögonen kan orsaka ögonirritation. Upprepad hudexponering kan orsaka lokal hudförstöring eller dermatit..
Upprepad inandning av damm kan ge varierande grad av irritation i luftvägarna eller lungskador. Upprepad eller långvarig inandning av damm kan orsaka kronisk andningsirritation (Säkerhetsdatablad Kalciumhydrid MSDS, 2005).
Vid kontakt med ögonen ska de sköljas omedelbart med mycket vatten i minst 15 minuter och ibland lyfta de övre och nedre ögonlocken..
Vid hudkontakt, skölj omedelbart med mycket vatten i minst 15 minuter medan du tar bort förorenade kläder och skor..
Vid förtäring ska kräkningar inte induceras. Ett giftkontrollcenter bör kallas. Det är lämpligt att lämna exponeringsplatsen och omedelbart flytta ut i det fria.
Vid inandning är det nödvändigt att tillföra syre om andningen är svår. Återupplivning från mun till mun bör inte ges om offret har svalt eller inandat ämnet..
Konstgjord andning bör induceras med hjälp av en fickmask försedd med envägsventil eller annan lämplig andningsmedicinsk utrustning. I alla fall bör läkare omedelbart fås..
Hantering och lagring
Föreningen ska förvaras i en torr behållare på avstånd från värme. Det bör hållas borta från antändningskällor. Damm ska inte andas. Vatten bör inte tillsättas till denna produkt
I händelse av otillräcklig ventilation, använd lämplig andningsutrustning såsom en filtermask. Vid exponering, kontakta läkare och visa etiketten där det är möjligt. Undvik kontakt med hud och ögon.
Brandfarligt material ska i allmänhet förvaras i en separat säkerhetsskåp eller ett förråd. Håll behållaren tätt stängd.
Förvara på en sval och väl ventilerad plats. All utrustning som innehåller material måste jordas för att undvika elektriska gnistor. Behållaren ska hållas torr och på en sval plats.
Det är ett icke-brandfarligt material. Brandmän bör emellertid bära lämplig utrustning när de bekämpar en brand runt denna kemiska förening..
Det är aldrig tillrådligt att använda vatten för att släcka en brand runt kalciumhydrid. Torr sand såväl som föreningar såsom natriumklorid och natriumkarbonat kan användas för detta ändamål..
För att avlägsna kalciumhydridavfall måste det sönderdelas genom att tillsätta 25 ml metanol för varje gram hydrid under en kväveatmosfär under omrörning..
När reaktionen är avslutad tillsätts samma volym vatten till den vattenhaltiga föreningen av kalciummetoxid och bortskaffas i avloppet med mycket vatten (National Research Council, 1995).
Användningar och applikationer
Torkmedel
Kaliumhydrid är ett relativt milt torkmedel. Av denna anledning är användningen av denna förening som torkmedel säkrare jämfört med mer reaktiva medel, såsom natrium-kalium- och natriummetalllegeringar. Reagerar med vatten enligt följande:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Hydrolysprodukterna från denna reaktion, väte (gas) och Ca (OH) 2 (en vattenblandning), kan separeras från det kemiska lösningsmedlet efter en process av filtrering, destillation eller dekantering..
Denna kemiska förening är ett effektivt torkmedel för många basiska lösningsmedel såsom aminer och pyridin. Används ibland för att torka lösningsmedel innan man använder mer reaktiva torkmedel.
Väteproduktion
På 1940-talet var denna förening tillgänglig som vätskekälla under handelsnamnet "Hydrolith.".
Det har använts som källa till väte under lång tid. Det används fortfarande för att producera rent väte i laboratorier för olika experiment, avancerade bränsleceller och batteriapplikationer (American Elements, S.F.).
Föreningen har använts allmänt i årtionden som ett säkert och bekvämt sätt att blåsa upp väderballonger..
Det används också regelbundet i laboratorier för att producera små mängder mycket rent väte för experiment. Fuktinnehållet i dieselbränsle beräknas från vätgas som utvecklats efter behandling med CaH2.
Reduktionsmedel
Vid upphettning mellan 600 och 1000 ° C kan zirkoniumoxid, niob, uran, krom, titan, vanadin och tantal reduceras för att bereda pulvret av dessa metaller, så kalciumhydrid kan användas i metallurgi av damm.
Följande reaktion illustrerar hur kalciumhydrid fungerar som reduktionsmedel:
TiO + 2CaH2 → CaO + H2 + Ti
Nackdel med användningen av kalciumhydrid
Denna kemiska förening är ofta det föredragna valet som torkmedel; Det har dock också några nackdelar:
-Torkningsverkan av denna förening är långsam, eftersom den inte är löslig i något lösningsmedel med vilken den inte reagerar våldsamt..
-Denna pulverformiga förening är oförenlig med många lösningsmedel. Dess reaktion med klorkolväten kan till och med orsaka explosioner.
-Det kan inte användas för deoxygenerande lösningsmedel eftersom det inte kan ta bort upplöst syre.
-Att skilja mellan kalciumhydrid och kalciumhydroxid är ganska svårt på grund av deras liknande utseende.
Referenser
- Amerikanska element. (S.F.). kalciumhydrid. Hämtad från americanelements.com: americanelements.com.
- Kalciumhydrid 7789-78-8. (2016). Hämtad från chemicalbook.com: chemicalbook.com.
- kalciumhydrid. (s.f.). Hämtad från kemilärare: chemistrylearner.com.
- Säkerhetsdatablad Kalciumhydrid MSDS. (2005, 10 oktober). Hämtad från sciencelab.com: sciencelab.com.
- Nationellt centrum för bioteknikinformation. (S.F.). PubChem Compound Database; CID = 105052. Hämtad från pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- Nationella forskningsrådet. (nittonhundranittiofem). Försiktiga metoder i laboratoriet: Hantering och bortskaffande av kemikalier. Washinton: NationalAacademy Press.
- Royal Society of Chemistry. (2015). kalciumhydrid ID 94784. Hämtad från chemspider.com: chemspider.com.
- UC-centrum för laboratoriesäkerhet. (2013, 18 januari). standardoperationsförfarande kalciumhydrid. Hämtad från chemengr.ucsb.edu: chemengr.ucsb.edu.



Ingen har kommenterat den här artikeln än.