
Natriumhydrid (NaH) egenskaper, reaktivitet, faror, användningar

De natriumhydrid Det är en oorganisk förening med formeln NaH. Den har en jonbindning mellan natrium och hydrid. Dess struktur illustreras i figur 1. Den är representativ för saltlösning, vilket betyder att det är en hydrid som liknar salt, bestående av Na + och H-joner, i motsats till mer molekylära hydrider såsom boran, metan, ammoniak och vatten.
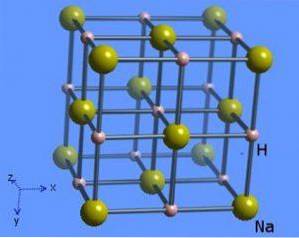
Kristallstrukturen har ett koordinationsnummer 6, där varje natriummolekyl är omgiven av åtta hydridjoner som har en oktaedrisk form och illustreras i figur 2 (Mark Winter [University of Sheffield and WebElements Ltd, 1993-2016).
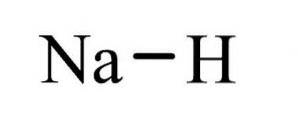
Föreningen framställs genom den direkta reaktionen mellan natrium och vätgas (Sodiumhydride Formula - Sodium hydide Uses, Properties, Structure and Formula, 2005-2017) enligt följande:
H2 + 2Na → 2NaH
Natriumhydrid säljs kommersiellt som en dispersionsform vid 60% vikt / vikt (vikt till viktprocent) i mineralolja för säker hantering (SODIUM HYDRIDE, n.d.).
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos natriumhydrid
- 2 Reaktivitet och faror
- 3 användningsområden
- 4 Referenser
Fysikaliska och kemiska egenskaper hos natriumhydrid
Natriumhydrid är en vit fast substans när den är ren, även om den i allmänhet är grå eller silverfärgad. Dess utseende visas i figur 3.

NaH har en molekylvikt på 23,99771 g / mol, en densitet på 1,396 g / ml och en smältpunkt på 800 ° C (Royal Society of Chemistry, 2015). Det är olösligt i ammoniak, bensen, koltetraklorid och koldisulfid (National Center for Biotechnology Information, n.d.).
Föreningen är extremt instabil. Ren NaH kan lätt antändas i luft. När det kommer i kontakt med vatten som finns i luften släpper det ut mycket brandfarligt väte.
När det är öppet för luft och fukt hydrolyseras NaH också lätt i den starka frätande basen av natriumhydroxid (NaOH) baserat på reaktionen:
NaH + H2O → NaOH + H2
I denna reaktion kan man se att natriumhydrid beter sig som en bas. Detta beror på elektronegativiteten.
Natrium har signifikant lägre elektronegativitet (≈1.0) än väte (≈2.1), vilket innebär att väte drar elektrontätheten mot sig själv och rör sig bort från natrium för att generera en natriumkatjon och en anjonhydrid.
För att en förening ska vara en Brønsted-syra måste den separera vätets elektrontäthet, det vill säga ansluta den till en elektronegativ atom såsom syre, fluor, kväve etc. Först då kan den formellt beskrivas som H + och kan dissocieras som sådan.
En hydrid beskrivs mycket bättre som H- och har ett fritt elektronpar. Som sådan är det en Brønsted-bas, inte en syra. Faktum är att om du utökar definitionen av Brønsted syra / bas på det sätt som Lewis gjorde kommer du till slutsatsen att natrium (Na +) är den sura arten här..
Brønsted-syra / basreaktionsprodukten av bas H- och syra H + blir H2. Eftersom surt väte extraheras direkt från vatten kan vätgas bubbla, vilket förskjuter jämvikt även om reaktionen inte gynnas termodynamiskt..
OH-joner kan finnas kvar som kan skrivas med resten av Na + -katjonen för att ge natriumhydroxid (Varför är fast natriumhydrid en bas och inte en syra när den reageras med vatten?, 2016).
Reaktivitet och faror
Föreningen är ett kraftfullt reduktionsmedel. Angriper SiO2 i glas. Tänds vid kontakt med gasformiga F2, Cl2, Br2 och I2 (den senare vid temperaturer över 100 ° C), speciellt i närvaro av fukt, för att bilda HF, HCl, HBr och HI.
Reagerar med svavel för att ge Na2S och H2S. Kan reagera explosivt med dimetylsulfoxid. Reagerar kraftigt med acetylen, även vid -60 ° C. Det är spontant brandfarligt i fluor.
Initierar en polymerisationsreaktion i etyl-2,2,3-trifluorpropionat, så att estern sönderdelas våldsamt. Närvaron i reaktionen av dietylsuccinat och etyltrifluoracetat har orsakat explosioner (SODIUM HYDRIDE, 2016).
Natriumhydrid anses frätande för huden eller ögonen på grund av risken för kaustiska biprodukter av reaktioner med vatten..
Vid kontakt med ögonen ska dessa sköljas med stora mängder vatten under ögonlocken i minst 15 minuter och kontakta läkare omedelbart..
Vid hudkontakt, borsta omedelbart och skölj det drabbade området med vatten. Sök läkare om irritation kvarstår..
Farligt vid förtäring på grund av reaktion på vatten. Framkalla inte kräkningar. Sök omedelbar läkarvård och överför offret till en medicinsk anläggning..
Dispersion av natriumhydridolja är inte pulver. Det reagerande materialet kan emellertid avge en fin kaustisk dimma. Vid inandning, skölj munnen med vatten och flytta personen till frisk luft. Sök läkarvård (Rhom and Hass inc., 2007).
Applikationer
Huvudanvändningen av natriumhydrid är att utföra kondens- och alkyleringsreaktioner som utvecklas genom bildandet av en karbanion (katalyserad av basen).
Natriumhydrid i olja liknar natrium- och natriummetallalkoholater i sin förmåga att fungera som ett deprotoneringsmedel i acetoättikester, Claisen, Stobbe, Dieckmann-kondens och andra relaterade reaktioner. Det har markerade fördelar jämfört med andra kondensmedel genom att:
- Det är en starkare bas, vilket resulterar i en mer direkt deprotonation.
- Inget överskott behövs.
- H2 som produceras ger ett mått på reaktionens omfattning.
- Sidoreaktioner som minskningar elimineras.
Alkyleringar av aromatiska och heterocykliska aminer såsom 2-aminopyridin och fenotiazin åstadkoms lätt i högt utbyte med användning av toluen-metylformamidblandningar. Dimetylformamidkoncentration är en variabel som används för att kontrollera reaktionshastigheten (HINCKLEY, 1957).
Användningen av natriumhydrid har föreslagits för lagring av väte för användning i bränslecellbärare, varvid hydrid är innesluten i plastgranuler som krossas i närvaro av vatten för att frigöra väte..
Referenser
- HINCKLEY, M. D. (1957). Tillverkning, hantering och användning av natriumhydrid. Advances in Chemistry, vol. 19, 106-117.
- Mark Winter [University of Sheffield and WebElements Ltd, U. (1993-2016). Natrium: natriumhydrid. Hämtad från WebElements: webelements.com.
- Nationellt centrum för bioteknikinformation. (s.f.). PubChem Compound Database; CID = 24758. Hämtad från PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom and Hass Inc. (2007, december). Natriumhydrid 60% dispersion i olja. Hämtad från dow.com.
- Royal Society of Chemistry. (2015). Natriumhydrid. Hämtad från ChemSpider: chemspider.com.
- NATRIUMHYDRID. (2016). Hämtad från cameochemicals: cameochemicals.noaa.gov.
- Sodiumhydride Formula - Sodiumhydride Använder, egenskaper, struktur och formel. (2005-2017). Hämtad från Softschools.com: softschools.com.
- NATRIUMHYDRID. (s.f.). Hämtad från chemicalland21: chemicalland21.com.
- Varför är fast natriumhydrid en bas och inte en syra när den reageras med vatten? (2016, 20 april). Hämtad från stackexchange: chemistry.stackexchange.com.



Ingen har kommenterat den här artikeln än.