
Ammoniumjon (NH4 +) formel, egenskaper och användningsområden

De ammoniumjon är en positivt laddad polyatomisk katjon vars kemiska formel är NH4+. Molekylen är inte platt, men är formad som en tetraeder. De fyra väteatomerna utgör de fyra hörnen.
Ammoniakkväve har ett odelat par elektroner som kan ta emot en proton (Lewis-bas), därför bildas ammoniumjonen genom protonering av ammoniak enligt reaktionen: NH3 + H+ → NH4+
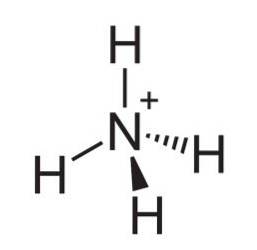
Namnet ammonium ges också till substituerade aminer eller substituerade ammoniumkatjoner. Exempelvis är metylammoniumklorid ett joniskt salt med formeln CH3NH4Cl där kloridjonen är bunden till en metylamin.
Ammoniumjonen har egenskaper som liknar de tyngre alkalimetallerna och anses ofta vara en nära släkting. Ammonium förväntas uppträda som en metall vid mycket höga tryck, som inuti gasjättplaneter som Uranus och Neptun..
Ammoniumjonen spelar en viktig roll i proteinsyntesen i människokroppen. Kort sagt, alla levande saker behöver proteiner, som består av cirka 20 olika aminosyror. Medan växter och mikroorganismer kan syntetisera de flesta aminosyror från kväve i atmosfären, kan djur inte..
För människor kan vissa aminosyror inte syntetiseras alls och måste konsumeras som essentiella aminosyror.
Andra aminosyror kan dock syntetiseras av mikroorganismer i mag-tarmkanalen med hjälp av ammoniakjoner. Således är denna molekyl en nyckelfigur i kvävecykeln och i proteinsyntesen..
Artikelindex
- 1 Fastigheter
- 1.1 Löslighet och molekylvikt
- 1.2 Syra-basegenskaper
- 1.3 Ammoniumsalter
- 2 användningsområden
- 3 Referenser
Egenskaper
Löslighet och molekylvikt
Ammoniumjonen har en molekylvikt på 18,039 g / mol och en löslighet på 10,2 mg / ml vatten (National Center for Biotechnology Information, 2017). Upplösning av ammoniak i vatten bildar ammoniumjonen enligt reaktionen:
NH3 + HtvåO → NH4+ + Åh-
Detta ökar hydroxylkoncentrationen i mediet genom att öka lösningens pH (Royal Society of Chemistry, 2015).
Syrabasegenskaper
Ammoniumjonen har en pKb av 9,25. Detta innebär att vid pH högre än detta värde kommer det att ha ett syrabeteende och vid lägre pH kommer det att ha ett grundläggande beteende..
Till exempel, vid upplösning av ammoniak i ättiksyra (pKa = 4,76) tar det fria elektronparet kväve en proton från mediet, vilket ökar koncentrationen av hydroxidjoner enligt ekvationen:
NH3 + CH3COOH ⇌ NH4+ + CH3KUTTRA-
I närvaro av en stark bas, såsom natriumhydroxid (pKa = 14,93), ger emellertid ammoniumjonen en proton till mediet enligt reaktionen:
NH4+ + NaOH-NH3 + Na+ + HtvåELLER
Sammanfattningsvis kommer kväve att protoneras vid pH mindre än 9,25, medan det vid pH överstiger det värdet deprotoneras. Detta är av yttersta vikt för att förstå titreringskurvor och förstå ämnen som aminosyror..
Ammoniumsalter
En av de mest karakteristiska egenskaperna hos ammoniak är dess förmåga att kombinera direkt med syror för att bilda salter beroende på reaktionen:
NH3 + HX → NH4X
Således bildar den med saltsyra ammoniumklorid (NH4Cl); Med salpetersyra, ammoniumnitrat (NH4INTE3med kolsyra bildar den ammoniumkarbonat ((NH4)tvåCO3) etc.
Det har visat sig att helt torr ammoniak inte kommer att kombineras med perfekt torr saltsyra, fukten är nödvändig för att orsaka reaktionen (VIAS Encyclopedia, 2004).
De flesta enkla ammoniumsalter är mycket lösliga i vatten. Ett undantag är ammoniumhexakloroplatinat, vars bildning används som ett test för ammonium. Salterna av ammoniumnitrat och särskilt perklorat är mycket explosiva, i dessa fall är ammonium reduktionsmedlet.
I en ovanlig process bildar ammoniumjoner en amalgam. Sådana arter framställs genom elektrolys av en ammoniumlösning med användning av en kvicksilverkatod. Denna amalgam sönderdelas så småningom för att frigöra ammoniak och väte (Johnston, 2014).
En av de vanligaste ammoniumsalterna är ammoniumhydroxid, som helt enkelt är ammoniak upplöst i vatten. Denna förening är mycket vanlig och finns naturligt i miljön (i luft, vatten och jord) och i alla växter och djur, inklusive människor..
Applikationer
Ammonium är en viktig kvävekälla för många växtarter, särskilt de som växer i hypoxiska jordar. Det är dock också giftigt för de flesta grödor och appliceras sällan som den enda kvävekällan (databas, Human Metabolome, 2017).
Kväve (N), bundet till proteiner i död biomassa, konsumeras av mikroorganismer och omvandlas till ammoniumjoner (NH4 +) som kan absorberas direkt av växtrötter (t.ex. ris).
Ammoniumjoner omvandlas vanligtvis till nitritjoner (NO2-) av nitrosomonas-bakterier, följt av en andra omvandling till nitrat (NO3-) av nitrobacter-bakterier..
De tre viktigaste kvävekällorna som används i jordbruket är urea, ammonium och nitrat. Den biologiska oxidationen av ammonium till nitrat är känd som nitrifikation. Denna process involverar flera steg och förmedlas av obligatoriska aeroba, autotrofa bakterier..
I översvämmade jordar är oxidation av NH4 + begränsad. Urea bryts ner av enzymet ureas eller hydrolyseras kemiskt till ammoniak och CO2.
I ammonifieringssteget omvandlas ammoniak genom ammonifierande bakterier till ammoniumjonen (NH4 +). I nästa steg omvandlas ammonium genom nitrifierande bakterier till nitrat (nitrifikation).
Denna mycket mobila kväveform absorberas oftast av växtrötter, liksom mikroorganismer i jorden..
För att stänga kvävecykeln omvandlas kvävgas i atmosfären till biomassa kväve av Rhizobium-bakterier som lever i rotvävnaderna av baljväxter (till exempel alfalfa, ärtor och bönor) och baljväxter (såsom al). Azotobacter (Sposito, 2011).
Genom ammonium (NH4 +) kan vattenväxter absorbera och införliva kväve i proteiner, aminosyror och andra molekyler. Höga koncentrationer av ammoniak kan öka tillväxten av alger och vattenväxter.
Ammoniumhydroxid och andra ammoniumsalter används ofta i livsmedelsbearbetning. Food and Drug Administration (FDA) föreskrifter anger att ammoniumhydroxid är säkert ("allmänt erkänt som säkert" eller GRAS) som jästmedel, pH-kontrollmedel och efterbehandlingsmedel. Ytligt i livsmedel.
Listan över livsmedel där ammoniumhydroxid används som direkt livsmedelstillsats är omfattande och innehåller bakverk, ostar, choklad, andra konfektyrprodukter (t.ex. godis) och puddingar. Ammoniumhydroxid används också som ett antimikrobiellt medel i köttprodukter.
Ammoniak i andra former (t.ex. ammoniumsulfat, ammoniumalginat) används i kryddor, sojaproteinisolat, snacks, sylt och gelé och alkoholfria drycker (PNA kaliumnitratförening, 2016).
Ammoniummätning används i RAMBO-testet, särskilt användbart vid diagnos av orsaken till acidos (Test-ID: RAMBO Ammonium, Random, Urine, S.F.). Njurarna reglerar syreutsöndring och systemisk syra-basbalans.
Att ändra mängden ammoniak i urinen är ett viktigt sätt för njurarna att göra detta. Att mäta ammoniaknivån i urinen kan ge insikt om orsaken till en syrabasbalansstörning hos patienter..
Nivån av ammoniak i urinen kan också ge mycket information om den dagliga syraproduktionen hos en given patient. Eftersom det mesta av en individs syrabelastning kommer från intaget protein är mängden ammoniak i urinen en bra indikator på proteinintaget.
Mätningar av urinammoniak kan vara särskilt användbara för diagnos och behandling av patienter med njursten:
- Höga nivåer av ammoniak i urinen och ett lågt pH i urinen tyder på pågående gastrointestinala förluster. Dessa patienter riskerar urinsyra och kalciumoxalatstenar..
- Lite ammoniak i urinen och högt pH i urinen tyder på renal tubulär acidos. Dessa patienter löper risk för kalciumfosfatsten.
- Patienter med kalciumoxalat och kalciumfosfatstenar behandlas ofta med citrat för att höja urincitrat (en naturlig hämmare av kalciumoxalat och kalciumfosfatkristalltillväxt)..
Men eftersom citrat metaboliseras till bikarbonat (en bas) kan detta läkemedel också öka urinens pH. Om urinens pH är för högt med citratbehandling kan risken för kalciumfosfatsten ökas av misstag..
Övervakning av ammoniak urin är ett sätt att titrera citratdosen och undvika detta problem. En bra startdos citrat är ungefär hälften av ammoniumutsöndringen i urinen (i mEq av vardera).
Effekten av denna dos på urinammonium-, citrat- och pH-värden kan övervakas och citratdosen kan justeras baserat på respons. En minskning av urinammonak bör indikera om det nuvarande citratet är tillräckligt för att delvis (men inte helt) motverka den dagliga syrabelastningen hos den givna patienten..
Referenser
- Databas, Human Metabolome. (2017, 2 mars). Visar metabokort för Ammonium. Återställd från: hmdb.ca.
- Johnston, F. J. (2014). Ammoniumsalt. hämtad från accessscience: accessscience.com.
- Nationellt centrum för bioteknikinformation. (2017, 25 februari). PubChem Compound Database; CID = 16741146. Hämtad från PubChem.
- PNA-kaliumnitratförening. (2016). Nitrat (NO3-) kontra ammonium (NH4 +). hämtad från kno3.org.
- Royal Society of Chemistry. (2015). Ammoniumjon. Återställd från chemspider: chemspider.com.
- Sposito, G. (2011, 2 september). Jord. Återställd från encyklopedi britannica: britannica.com.
- Test-ID: RAMBO ammonium, slumpmässig, urin. (S.F.). Återställd från encyklopediamayomedicallaboratorie.com.
- VIAS Encyclopedia. (2004, 22 december). Ammoniumsalter. Återställd från encyklopedi vias.org.

Ingen har kommenterat den här artikeln än.