
Beer-Lambert lagansökningar och lösta övningar
De Beer-Lambert-lag (Beer-Bouguer) är en som relaterar absorptionen av elektromagnetisk strålning från en eller flera kemiska arter, med dess koncentration och avståndet som ljuset rör sig i partikel-foton-interaktioner. Denna lag sammanför två lagar i en.
Bougues lag (även om erkännandet har fallit mer på Heinrich Lambert) fastställer att ett prov kommer att absorbera mer strålning när dimensionerna på det absorberande mediet eller materialet är större; specifikt dess tjocklek, vilket är avståndet l att ljuset färdas vid in- och utresa.
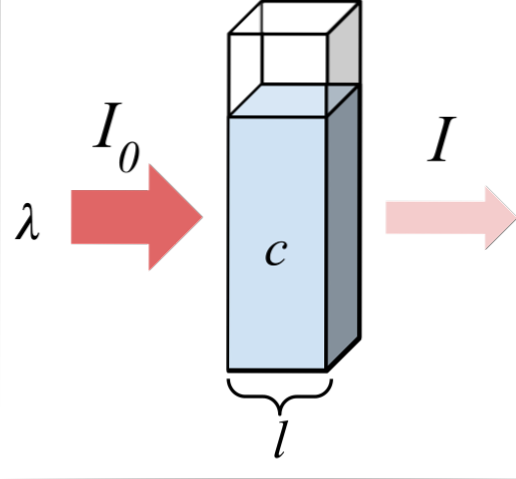
Den övre bilden visar absorptionen av monokromatisk strålning; det vill säga består av en enda våglängd, λ. Det absorberande mediet är inuti en optisk cell vars tjocklek är l, och innehåller kemiska arter med en koncentration c.
Ljusstrålen har en initial och slutlig intensitet, betecknad med symbolerna I0 respektive jag. Observera att efter att ha interagerat med det absorberande mediet är jag mindre än jag0, vilket visar att det fanns absorption av strålning. Ju äldre de är c Y l, mindre blir jag med avseende på jag0; det vill säga det blir mer absorption och mindre transmittans.
Artikelindex
- 1 Vad är Beer-Lambert-lagen?
- 1.1 Absorbans och transmittans
- 1.2 Grafik
- 2 applikationer
- 3 Lösta övningar
- 3.1 Övning 1
- 3.2 Övning 2
- 4 Referenser
Vad är Beer-Lambert-lagen?
Bilden ovan omfattar perfekt denna lag. Absorptionen av strålning i ett prov ökar eller minskar exponentiellt som en funktion av c eller l. För att fullständigt och enkelt förstå lagen är det nödvändigt att täcka dess matematiska aspekter.
Som just nämnts, jag0 och jag är intensiteterna hos den monokromatiska ljusstrålen före respektive efter ljuset. Vissa texter föredrar att använda symbolerna P0 och P, som hänvisar till strålningens energi och inte till dess intensitet. Här fortsätter förklaringen med hjälp av intensiteterna.
För att linjärisera ekvationen av denna lag måste logaritmen tillämpas, i allmänhet basen 10:
Logg (I0/ I) = εlc
Termen (I0/ I) indikerar hur mycket intensiteten hos absorptionens strålningsprodukt minskar. Lamberts lag tar endast hänsyn till l (εl), medan Beers lag ignorerar l, men placerar c istället (εc). Den övre ekvationen är föreningen av båda lagarna och är därför det allmänna matematiska uttrycket för Beer-Lambert-lagen.
Absorbans och transmittans
Absorbansen definieras av termen Log (I0/ I). Sålunda uttrycks ekvationen enligt följande:
A = εlc
Där ε är extinktionskoefficienten eller molarabsorptionsförmågan, som är konstant vid en given våglängd.
Observera att om tjockleken på det absorberande mediet hålls konstant, som ε, beror absorbansen A bara på koncentrationen c, av absorberande arter. Det är också en linjär ekvation, y = mx, där Y är A, och x det är c.
När absorbansen ökar minskar transmittansen; det vill säga hur mycket strålning som lyckas överföras efter absorption. De är därför inversa. Ja jag0/ I anger graden av absorption, I / I0 är lika med transmittans. Att veta detta:
Jag / jag0 = T
(Jag0/ I) = 1 / T
Logg (I0/ I) = Logg (1 / T)
Men Logg (jag0/ I) är också lika med absorbansen. Så förhållandet mellan A och T är:
A = Logg (1 / T)
Och tillämpa logaritmens egenskaper och veta att Log1 är lika med 0:
A = -LogT
Transmittanser uttrycks vanligtvis i procent:
% T = I / I0∙ 100
Diagram
Som tidigare nämnts motsvarar ekvationerna en linjär funktion; därför förväntas det att när de grafer dem kommer de att ge en rad.
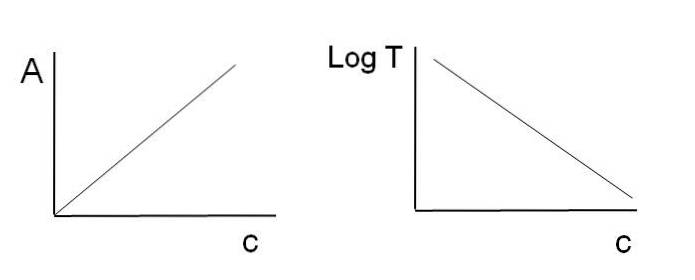
Observera att till vänster om bilden ovan finns linjen som erhålls genom att rita A mot c, och till höger linjen som motsvarar grafen för LogT mot c. En har en positiv lutning och den andra negativ; ju högre absorbans, desto lägre transmittans.
Tack vare denna linjäritet kan koncentrationen av de absorberande kemiska arterna (kromoforer) bestämmas om det är känt hur mycket strålning de absorberar (A) eller hur mycket strålning som överförs (LogT). När denna linjäritet inte observeras sägs det att den står inför en avvikelse, positiv eller negativ, av Beer-Lambert-lagen.
Applikationer
I allmänhet nämns några av de viktigaste tillämpningarna av denna lag nedan:
-Om en kemisk art visar färg är det en exemplifierande kandidat att analyseras med kolorimetriska tekniker. Dessa är baserade på Beer-Lambert-lagen och gör det möjligt att bestämma analyternas koncentration som en funktion av absorbansen som erhålls med en spektrofotometer..
-Det gör det möjligt att konstruera kalibreringskurvor, med vilka, med hänsyn till provets matriseffekt, bestäms koncentrationen av arten av intresse.
-Det används ofta för att analysera proteiner, eftersom flera aminosyror har signifikanta absorptioner i det ultravioletta området i det elektromagnetiska spektrumet..
-Kemiska reaktioner eller molekylära fenomen som medför en färgförändring kan analyseras med hjälp av absorbansvärden vid en eller flera våglängder..
-Med hjälp av multivariat analys kan komplexa blandningar av kromoforer analyseras. På detta sätt kan koncentrationen av alla analyter bestämmas och blandningarna kan också klassificeras och differentieras från varandra; exempelvis utesluta om två identiska mineraler kommer från samma kontinent eller specifika land.
Lösta övningar
Övning 1
Vad är absorbansen hos en lösning som uppvisar en transmittans på 30% vid en våglängd på 640 nm??
För att lösa det, gå bara till definitionerna av absorbans och transmittans.
% T = 30
T = (30/100) = 0,3
Och att veta att A = -LogT, beräkningen är enkel:
A = -Log 0,3 = 0,5228
Observera att den saknar enheter.
Övning 2
Om lösningen från föregående övning består av en art W vars koncentration är 2,30 ∙ 10-4 M, och förutsatt att cellen är 2 cm tjock: vad ska dess koncentration vara för att erhålla en transmittans på 8%??
Det kan lösas direkt med denna ekvation:
-LogT = εlc
Men värdet på ε är okänt. Därför måste den beräknas med tidigare data, och det antas att den förblir konstant över ett stort antal koncentrationer:
ε = -LogT / lc
= (-Log 0,3) / (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 M-1∙ cm-1
Och nu kan du gå vidare till beräkningen med% T = 8:
c = -LogT / εl
= (-Log 0,08) / (1136,52 M-1∙ cm-1 x 2 cm)
= 4,82 ∙ 10-4 M
Sedan räcker det för W-arten att fördubbla sin koncentration (4,82 / 2,3) för att minska dess transmittansprocent från 30% till 8%..
Referenser
- Day, R., & Underwood, A. (1965). Kvantitativ analytisk kemi. (femte upplagan). PEARSON Prentice Hall, s 469-474.
- Skoog D.A., West D.M. (1986). Instrumental analys. (andra upplagan). Interamericana., Mexiko.
- Soderberg T. (18 augusti 2014). Beer-Lambert-lagen. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Clark J. (maj 2016). Beer-Lambert-lagen. Återställd från: chemguide.co.uk
- Kolorimetrisk analys: Öls lag eller spektrofotometrisk analys. Återställd från: chem.ucla.edu
- Dr. J.M. Fernandez Alvarez. (s.f.). Analytisk kemi: manual för lösta problem. [PDF]. Återställd från: dadun.unav.edu



Ingen har kommenterat den här artikeln än.