
Idealisk gaslagsformel och enheter, applikationer, exempel
De ideal gaslag är en tillståndsekvation som beskriver ett förhållande mellan tillståndsfunktionerna associerade med den ideala gasen; såsom temperatur, tryck, volym och antal mol. Denna lag gör det möjligt att studera riktiga gasformiga system genom att jämföra dem med deras idealiserade versioner..
En idealgas är en teoretisk gas, som består av punkt- eller sfäriska partiklar som rör sig slumpmässigt; med stor kinetisk energi, där den enda interaktionen mellan dem är helt elastiska chocker. Dessutom följer de den ideala gaslagen.

Vid standardtryck och temperatur (STP): 1 atm tryck och en temperatur på 0 ºC, beter de flesta av de verkliga gaserna sig kvalitativt som ideala gaser; så länge deras densiteter är låga. Stora intermolekylära eller interatomära avstånd (för ädelgaser) underlättar sådana approximationer..
Under STP-förhållanden beter sig syre, kväve, väte, ädelgaser och vissa gaser i sammansatt form, såsom koldioxid, som en idealisk gas..
Den ideala gasmodellen tenderar att misslyckas vid låga temperaturer, höga tryck och höga partikeldensiteter; när intermolekylära interaktioner, liksom partikelstorlek, blir viktiga.
Den ideala gaslagen är en sammansättning av tre gaslagar: Boyle och Mariottes lag, Charles och Gay-Lussacs lag och Avogadros lag..
Artikelindex
- 1 Formel och enheter
- 2 Vad fastställer den ideala gaslagen?
- 3 applikationer
- 3.1 Beräkning av gasens densitet och molära massa
- 3.2 Beräkning av volymen av en gas som produceras vid en kemisk reaktion
- 3.3 Beräkning av det partiella trycket av gaser som finns i en blandning
- 3.4 Volym av gaser som samlas upp i vatten
- 4 Exempel på beräkningar
- 4.1 Övning 1
- 4.2 Övning 2
- 4.3 Övning 3
- 4.4 Övning 4
- 5 Referenser
Formel och enheter

Gaslagen uttrycks matematiskt med formeln:
PV = nRT
Där P är det tryck som utövas av en gas. Det uttrycks vanligtvis med atmosfärsenheten (atm), även om det kan uttryckas i andra enheter: mmHg, pascal, bar, etc..
Volymen V som upptas av en gas uttrycks vanligtvis i liter liter (L). Medan n är antalet mol, R den universella gaskonstanten och T temperaturen uttryckt i Kelvin (K).
Det mest använda uttrycket i gaser för R är lika med 0,08206 L atm K-1Mol-1. Även om SI-enheten för gaskonstanten har ett värde av 8,3145 J mol-1K-1. Båda är giltiga så länge man tar hand om enheterna för de andra variablerna (P, T och V).
Den ideala gaslagen är en kombination av Boyle-Mariottes lag, Charles-Gay-Lussacs lag och Avogadros lag.
Boyle-Mariotte lag
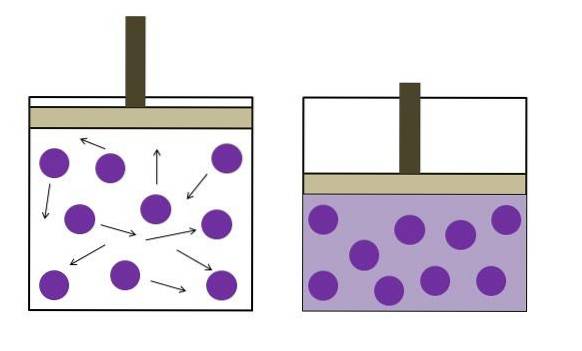
Det formulerades oberoende av fysikern Robert Boyle (1662) och fysikern och botanikern Edme Mariotte (1676). Lagen anges enligt följande: vid konstant temperatur är volymen för en fast massa av en gas omvänt proportionell mot trycket den utövar.
PV ∝ k
Genom att använda ett kolon:
P1V1 = PtvåVtvå
Charles-Gay-Lussac lag

Lagen publicerades av Gay-Lussac 1803, men den hänvisade till det opublicerade verket av Jacques Charles (1787). Av denna anledning är lagen känd som Charles lag..
Lagen säger att vid konstant tryck finns det ett direkt proportionellt förhållande mellan volymen som upptas av en gas och dess temperatur.
V ∝ ktvåT
Genom att använda ett kolon:
V1/ T1 = Vtvå/ Ttvå
V1Ttvå = VtvåT1
Avogadros lag
Lagen förklarades av Amadeo Avogadro 1811 och påpekade att lika stora volymer av alla gaser, vid samma tryck och temperatur, har samma antal molekyler.
V1/ n1 = Vtvå/ ntvå
Vad anger den ideala gaslagen?
Den ideala gaslagen etablerar ett förhållande mellan fyra oberoende fysiska egenskaper hos gas: tryck, volym, temperatur och kvantitet av gasen. Det räcker att känna till värdet av tre av dem, för att kunna få de återstående.
Lagen fastställer villkoren som indikerar när en gas beter sig optimalt och när den rör sig bort från detta beteende.
Till exempel har den så kallade kompressionsfaktorn (PV / nRT) ett värde på 1 för ideala gaser. Ett avvikelse från värdet 1 för kompressionsfaktorn indikerar att gasens beteende är långt ifrån det som visas av en idealgas.
Därför skulle ett misstag göras när den ideala gasekvationen tillämpas på en gas som inte beter sig enligt modellen.
Applikationer
Beräkning av gasens densitet och molära massa
Den ideala gaslagsekvationen kan användas för att beräkna gasens densitet och dess molära massa. Genom att göra en enkel modifiering kan ett matematiskt uttryck hittas som relaterar gasens densitet (d) och dess molmassa (M):
d = MP / RT
Och rensa M:
M = dRT / P
Beräkning av volymen av en gas som produceras i en kemisk reaktion
Stökiometri är den kemgren som relaterar mängden av var och en av de närvarande reaktanterna med de produkter som deltar i en kemisk reaktion, generellt uttryckt i mol..
Användningen av den ideala gasekvationen möjliggör bestämning av volymen för en gas som produceras i en kemisk reaktion; eftersom antalet mol kan erhållas från den kemiska reaktionen. Sedan kan gasens volym beräknas:
PV = nRT
V = nRT / P
Genom att mäta V kan utbytet eller förloppet för nämnda reaktion bestämmas. När det inte finns fler gaser är det en indikation på att reagensen är helt uttömda.
Beräkning av det partiella trycket av gaser som finns i en blandning
Idealgaslagen kan användas tillsammans med Daltons partiella trycklag för att beräkna partialtrycket för de olika gaserna som finns i en gasblandning..
Relationen gäller:
P = nRT / V
För att hitta trycket för var och en av de gaser som finns i blandningen.
Volym av gaser som samlas upp i vatten
En reaktion utförs som producerar en gas som samlas upp med hjälp av en experimentell design i vatten. Gasens totala tryck plus vattenångstrycket är känt. Värdet på det senare kan erhållas i en tabell och genom subtraktion kan gasens tryck beräknas.
Från stökiometrin för den kemiska reaktionen kan antalet mol av gasen erhållas och tillämpning av förhållandet:
V = nRT / P
Volymen producerad gas beräknas.
Beräkningsexempel
Övning 1
En gas har en densitet på 0,0847 g / L vid 17 ° C och ett tryck på 760 torr. Vad är dess molära massa? Vad är gas?
Vi börjar från ekvationen
M = dRT / P
Vi konverterar först temperaturenheterna till kelvin:
T = 17 ºC + 273,15 K = 290,15 K
Och trycket på 760 torr motsvarar trycket på 1 atm. Nu behöver du bara ersätta värdena och lösa:
M = (0,0847 g / L) (0,08206 L atm K-1Mol-1) (290,15 K) / 1 atm
M = 2,016 g / mol
Denna molära massa kan motsvara en enda art: den diatomiska vätemolekylen, Htvå.
Övning 2
En massa på 0,00553 g kvicksilver (Hg) i gasfasen finns i en volym av 520 L och vid en temperatur av 507 K. Beräkna trycket som utövas av Hg. Molmassan för Hg är 200,59 g / mol.
Problemet löses med hjälp av ekvationen:
PV = nRT
Information om antalet mol Hg visas inte; men de kan erhållas med hjälp av deras molära massa:
Antal mol Hg = (0,00553 g Hg) (1 mol Hg / 200,59 g)
= 2757 10-5 mol
Nu måste vi bara lösa för P och ersätta värdena:
P = nRT / V
= (2757 10-5 mol) (8,20610-två L atm K-1Mol-1) (507 K) / 520 L.
= 2,2 10-6 bankomat
Övning 3
Beräkna det tryck som alstras av saltsyran som produceras genom att reagera 4,8 g klorgas (Cltvåmed vätgas (Htvå), i en volym av 5,25 L och vid en temperatur av 310 K. Molmassan av Cltvå är 70,9 g / mol.
H2 g) + Cl2 g) → 2 HCl(g)
Problemet löses med den ideala gasekvationen. Men mängden HCl uttrycks i gram och inte i mol, så den korrekta omvandlingen görs.
Mol HCl = (4,8 g Cltvå(1 mol Cltvå/ 70,9 g Cltvå(2 mol HCl / 1 mol Cltvå)
= 0,135 mol HCl
Tillämpa den ideala gaslagsekvationen:
PV = nRT
P = nRT / V
= (0,135 mol HCl) (0,08206 1 atm K-1Mol-1) (310 K) / 5,25 L.
= 0,65 atm
Övning 4
Ett 0,130 g prov av en gasformig förening upptar en volym av 140 ml vid en temperatur av 70 ° C och ett tryck av 720 torr. Vad är dess molära massa?
För att tillämpa den ideala gasekvationen måste först flera ändringar göras:
V = (140 ml) (1 L / 1000 ml)
= 0,14 L.
Om vi tar volymen i liter måste vi nu uttrycka temperaturen i kelvin:
T = 70 ºC + 273,15 K = 243,15 K
Och slutligen måste vi konvertera trycket i atmosfärenheter:
P = (720 torr) (1 atm / 760 torr)
= 0,947 atm
Det första steget för att lösa problemet är att erhålla antalet mol av föreningen. För detta används den ideala gasekvationen och vi löser för n:
PV = nRT
n = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 L atm K-1Mol-1) (243,15 K)
= 0,067 mol
Du behöver bara beräkna molmassan genom att dividera gram med mol erhållna:
Molmassa = gram förening / antal mol.
= 0,130 g / 0,067 mol
= 19,49 g / mol
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Ira N. Levine. (2014). Principer för fysikalisk kemi. Sjätte upplagan. Mc Graw Hill.
- Glasstone. (1970). Avhandling om fysisk kemi. Andra upplagan. Aguilar.
- Mathews, C. K., Van Holde, K. E. och Ahern, K. G. (2002). Biokemi. 3det var Utgåva. Utgivare Pearson Addison Wesley.
- Wikipedia. (2019). Idealisk gas. Återställd från: en.wikipedia.org
- Redaktionellt team. (2018). Boyles lag eller Boyle-Mariottes lag | Lagar om gaser. Återställd från: iquimicas.com
Ingen har kommenterat den här artikeln än.