
Schrödinger Atomic Model Characteristics, Postulates

De Schrödingers atommodell utvecklades av Erwin Schrödinger 1926. Detta förslag är känt som atomens kvantmekaniska modell och beskriver elektronens vågbeteende.

Schrödinger föreslog att elektronernas rörelse i atomen motsvarade vågpartikel dualiteten, och följaktligen kunde elektronerna röra sig runt kärnan som stående vågor..
Schrödinger, som tilldelades Nobelpriset 1933 för sina bidrag till atomteorin, utvecklade ekvationen med samma namn för att beräkna sannolikheten för att en elektron är i en specifik position.
Artikelindex
- 1 Egenskaper för Schrödingers atommodell
- 2 experiment
- 2.1 Youngs experiment: den första demonstrationen av vågpartikel dualitet
- 2.2 Schrödinger-ekvationen
- 3 Postulat
- 4 Artiklar av intresse
- 5 Referenser
Kännetecken för den atommodellen av Schrödinger
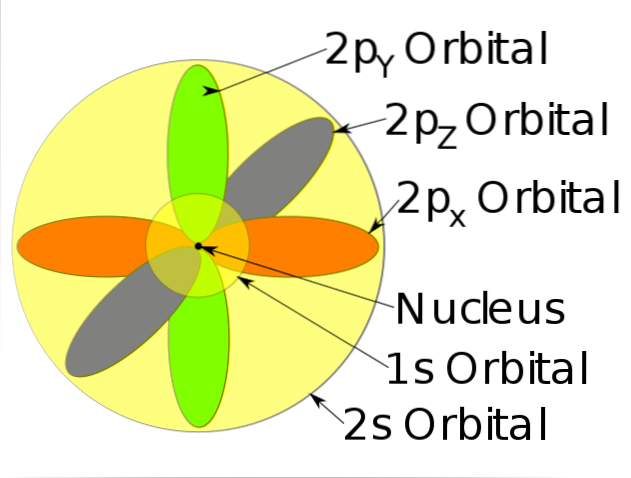
-Beskriv rörelsen av elektroner som stående vågor.
-Elektroner rör sig ständigt, det vill säga de har inte en fast eller definierad position inom atomen.
-Denna modell förutsäger inte elektronens placering, och den beskriver inte heller vägen den tar inom atomen. Skapa bara en sannolikhetszon för att lokalisera elektronen.
-Dessa sannolikhetsområden kallas atomorbitaler. Orbitalerna beskriver en translationell rörelse runt atomkärnan.
-Dessa atomorbitaler har olika energinivåer och subnivåer och kan definieras mellan elektronmoln.
-Modellen överväger inte kärnans stabilitet, den hänvisar bara till att förklara kvantmekaniken associerad med elektronernas rörelse i atomen..

Experimentera
Schrödingers atommodell bygger på Broglie-hypotesen, liksom på de tidigare atommodellerna av Bohr och Sommerfeld.
Broglie föreslog att precis som vågor har egenskaper hos partiklar, har partiklar egenskaper hos vågor, med tillhörande våglängd. Något som genererade mycket förväntningar vid den tiden, eftersom Albert Einstein själv stöder sin teori.
De Broglie-teorin hade emellertid en brist, som var att innebörden av själva idén inte var väl förstådd: en elektron kan vara en våg, men vad? Det är då som figuren av Schrödinger verkar ge ett svar.
För att göra detta litade den österrikiska fysikern på Youngs experiment, och baserat på sina egna observationer utvecklade han det matematiska uttrycket som bär hans namn.
Här är de vetenskapliga grunderna för denna atommodell:
Youngs experiment: den första demonstrationen av vågpartikel dualitet
De Broglie-hypotesen om materiens undulerande och korpuskulära natur kan demonstreras med hjälp av Youngs experiment, även känt som experimentet med dubbelslits..
Den engelska forskaren Thomas Young lade grunden för Schrödingers atommodell när han 1801 utförde experimentet för att verifiera vågens natur.
Under sitt experiment delade Young ut strålningen från en ljusstråle som passerar genom ett litet hål genom en observationskammare. Denna uppdelning uppnås genom att använda ett 0,2 millimeter kort, som ligger parallellt med strålen..
Utformningen av experimentet gjordes så att ljusstrålen var bredare än kortet, så när kortet placerades horisontellt delades strålen upp i två ungefär lika stora delar. Ljusstrålarnas utsignal styrdes av en spegel.
Båda ljusstrålarna träffade en vägg i ett mörkt rum. Där framkom interferensmönstret mellan de två vågorna, vilket visade att ljuset kunde bete sig både som en partikel och som en våg..
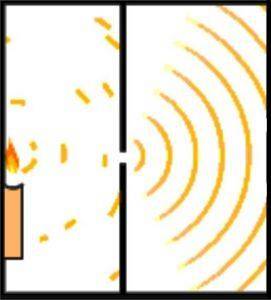
Ett sekel senare förstärkte Albert Einsten idén med hjälp av kvantmekanikens principer..
Schrödinger-ekvationen
Schrödinger utvecklade två matematiska modeller, som differentierade vad som händer beroende på om kvanttillståndet förändras med tiden eller inte.
För atomanalys publicerade Schrödinger den tidsoberoende Schrödinger-ekvationen i slutet av 1926, som baseras på det faktum att vågfunktioner beter sig som stående vågor.
Detta antyder att vågen inte rör sig, dess noder, det vill säga dess jämviktspunkter, fungerar som en sväng för resten av strukturen att röra sig runt dem och beskriver en specifik frekvens och amplitud..
Schrödinger definierade vågorna som beskriver elektroner som stationära eller orbitala tillstånd, och de är i sin tur associerade med olika energinivåer.
Den tidsoberoende Schrödinger-ekvationen är som följer:
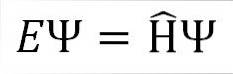
Var:
OCH: konstant av proportionalitet.
Ψ: kvantsystemets vågfunktion.
Η ̂: Hamilton-operatör.
Den tidsoberoende Schrödinger-ekvationen används när det observerbara som representerar systemets totala energi, känd som Hamilton-operatören, inte beror på tid. Funktionen som beskriver den totala vågrörelsen beror dock alltid på tiden..
Schrödinger-ekvationen indikerar att om vi har en vågfunktion Ψ, och den Hamiltoniska operatören verkar på den, representerar proportionalitetskonstanten E den totala energin i kvantsystemet i ett av dess stationära tillstånd.
Tillämpad på Schrödingers atommodell, om elektronen rör sig i ett definierat utrymme finns det diskreta energivärden, och om elektronen rör sig fritt i rymden finns det kontinuerliga energiintervall.
Ur matematisk synpunkt finns det flera lösningar för Schrödinger-ekvationen, varje lösning innebär ett annat värde för proportionalitetskonstanten E.
Enligt Heisenbergs osäkerhetsprincip är det inte möjligt att uppskatta en elektrons position och energi. Följaktligen inser forskare att uppskattningen av elektronens placering i atomen är felaktig..
Postulat
Postulaten i Schrödingers atommodell är följande:
-Elektroner beter sig som stående vågor som fördelas i rymden enligt vågfunktionen Ψ.
-Elektroner rör sig inuti atomen i orbitaler. Detta är områden där sannolikheten för att hitta en elektron är betydligt högre. Den hänvisade sannolikheten är proportionell mot kvadratet för vågfunktionen Ψtvå.
Elektronkonfigurationen i Schrödinguers atommodell förklarar de periodiska egenskaperna hos atomer och bindningarna de bildar.
Schrödingers atommodell tar dock inte hänsyn till elektroners snurrning och inte heller variationer i snabba elektroners beteende på grund av relativistiska effekter..
Artiklar av intresse
Atomic de Broglie-modellen.
Chadwick Atomic Model.
Heisenberg atommodell.
Perrins atommodell.
Thomsons atommodell.
Dalton atommodell.
Dirac Jordan atommodell.
Atommodell för Democritus.
Atommodell av Leucippus.
Bohr atommodell.
Sommerfeld atommodell.
Nuvarande atommodell.
Referenser
- Schrodingers atommodell (2015). Återställd från: quimicas.net
- Den kvantmekaniska modellen för atomen Återställd från: en.khanacademy.org
- Schrödingers vågekvation (s.f.). Jaime I. Castellón University, Spanien. Återställd från: uji.es
- Modern atomteori: modeller (2007). © ABCTE. Återställd från: abcte.org
- Schrodingers Atomic Model (s.f.). Återställd från: erwinschrodingerbiography.weebly.com
- Wikipedia, The Free Encyclopedia (2018). Schrödinger ekvation. Återställd från: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2017). Youngs experiment. Återställd från: es.wikipedia.org



Ingen har kommenterat den här artikeln än.