
Molaritetskoncentration, enheter, beräkning, övningar
De molaritet är koncentrationen av en lösning uttryckt i mol löst material per liter lösning. Det förkortas som M och uttrycker ett förhållande mellan massan av löst ämne och volym av lösningen (m / v); även om traditionellt detta förhållande uttrycks som vikt till volym.
En mol är antalet atomer eller molekyler som ingår i atom- eller molekylvikten; Det uttrycks i gram / mol. En mol är lika med 6.02 · 102. 3 atomer eller molekyler, känd som Avogadros nummer.
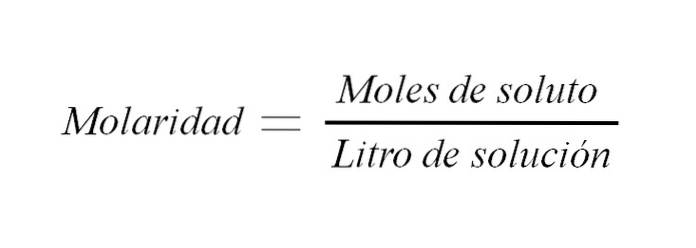
Det finns andra sätt att uttrycka förhållandet mellan massan av en löst substans och volymen, inklusive: det procentuella förhållandet mellan massan av den lösta produkten och volymen av lösningen och normalitet. Den senare uttrycks som antalet ekvivalenter av en löst substans per liter lösning.
Under tiden uttrycker molalitet, som definieras som antalet mol per kg lösningsmedel, vanligtvis vatten, ett förhållande mellan massan av lösningsmedlet och massan av lösningsmedlet (m / m)..
Formen för uttryck av koncentrationen av en lösning i delar per miljon (ppm), uttrycker ett förhållande mellan en del av det lösta ämnet och en miljon delar av lösningen, som vanligtvis används för att uttrycka ett mass-mass-förhållande (m / m) . Men du kan uttrycka en massa-volym-relation (m / v).
Molekoncentrationen kan, förutom att den uttrycks i mol per liter, uttryckas som millimol / liter (millimolär lösning); mikromol / liter (mikromolär lösning); etc.
Molaritetsproblem kan lösas med en analytisk metod och med "regeln om tre". Valet av metod beror på den skicklighet du har i användningen av en av metoderna.
Artikelindex
- 1 molkoncentration
- 2 enheter
- 3 Hur man beräknar molaritet?
- 4 Gå från molaritet till molalitet
- 4.1 Första steget
- 4.2 Andra steget
- 4.3 Tredje steget
- 4.4 Fjärde steget
- 4.5 Femte steget
- 4.6 Numeriskt exempel
- 5 Problem löst
- 5.1 Problem 1
- 5.2 Problem 2
- 5.3 Problem 3
- 5.4 Uppgift 4
- 5.5 Problem 5
- 6 Referenser
Molekoncentration
Den används för att uttrycka koncentrationen av en löst substans i en given volym lösning.
M = n / V (1)
Där M är lika med molaritet är n antalet mol och V är lösningsvolymen. Så, molariteten för en lösning är antalet mol löst ämne per volym lösning uttryckt i liter.
Å andra sidan är antalet mol
n = m / PM (2)
Där m är den upplösta lösningsmedlets massa och PM dess molära massa.
Ersätter (2) i (1):
M = (m / PM) / V.
Enheter
Enheten i det internationella systemet för molkoncentration är mol / m3. Detta motsvarar en millimolär lösning, eftersom am3 motsvarar 1000 liter. I grenarna inom kemi och biologi uttrycks molkoncentration vanligtvis som mol / L. Enheten uttrycks med M (versaler).
En lösning av en mol / L är ekvivalent med en lösning M; en lösning av 10-3 mol / L, lika med 1 mM (millimolar); och en lösning av 10-6 mol / L, lika med 1 uM (mikromolar).
Hur man beräknar molaritet?
Det är bekvämt att använda de ovan angivna uttrycken, eftersom detta säkerställer att resultatet av appliceringen av formeln ger i mol / liter, vilket är definitionen av molkoncentration.
För att beräkna molariteten för en lösning är det nödvändigt att uttrycka koncentrationen av det lösta ämnet i g / L. Hitta sedan molekylvikten för det lösta ämnet (g / mol) och hitta förhållandet mellan koncentrationen och molekylvikten. Det erhållna resultatet är molariteten uttryckt i mol / liter.
Gå från molaritet till molalitet
En nödvändig information för att gå från molaritet till molalitet är att känna till lösningens densitet. Detta gör det möjligt att känna till lösningens massa, ett väsentligt krav för beräkning av molalitet..
Första steget
Först måste du gå från molkoncentrationen till gram / liter. För att göra detta räcker det att multiplicera lösningens molaritet med lösningsmedlets molekylvikt..
Gram / liter löst ämne = molaritet (mol / liter) · molekylvikt av löst ämne (gram / mol).
Detta gör det möjligt att erhålla massan av det lösta ämnet i 1 liter lösning.
Andra steg
Då är det nödvändigt att beräkna lösningens massa. För detta används densiteten. Vanligtvis uttrycks densiteten i gram / kubikcentimeter eller milliliter.
Massan av lösningen (g) = volym av lösningen (ml) densitet (g / ml)
Tredje steget
Skaffa lösningsmedlets massa. Eftersom massan av lösningen är lika med massan av lösningsmedlet plus massan av lösningsmedlet, för att erhålla massan av det senare är det tillräckligt att subtrahera massan av lösningen (steg 1) från massan av lösningen ( steg 2)..
Fjärde steget
Slutligen måste den lösta massan (g) av lösningen överföras till den lösta massan som motsvarar 1 000 g eller 1 kg lösningsmedel. För att göra detta skulle det vara tillräckligt att utföra en enkel regel med tre eller andra motsvarande matematiska operationer.
Femte steget
Dela g löst ämne / 1000 g lösningsmedel med lösningsmedlets molekylvikt (g / mol) för att erhålla lösningens molalitet.
Numeriskt exempel
En 3 M glukoslösning (molekylvikt 180 g / mol) har en densitet av 1,15 g / ml. Beräkna molaliteten för denna lösning.
Vi beräknar först gram glukos löst i en liter lösning:
g / L = 3 mol / L 180 g / mol
= 540 g / l
Därefter beräknar vi massan av lösningen utifrån densiteten:
g lösning (massa) = 1000 ml 1,15 g / ml
= 1150 g
Massan av lösningsmedel ges av skillnaden:
Massa av lösningsmedel = massa av lösning - massa av löst ämne
= 1150 g - 540 g
= 610 g
Men 610 g är inte 1000 g lösningsmedel enligt definitionen av molalitet. Därför måste det beräknas hur många gram glukos som löses i 1000 g lösningsmedel:
Massa av löst ämne = 540 g löst ämne (1000 g lösningsmedel / 610 g lösningsmedel)
= 885,25 g
Och slutligen beräknas molaliteten genom att återställa gram till mol:
Molalitet = (885,25 g löst ämne / 180 g / mol)
= 4,92 mol löst / kg lösningsmedel
= 4,92 m
Problem lösta
Problem 1
Hur mycket kopparsulfat tar det för att bereda 500 ml av en 0,4 M lösning? Uttrycka resultatet i gram. Molekylvikt av kopparsulfat (CuSO4160 g / mol.
Vi bestämmer först molen som måste lösas i en sådan lösning:
M = n / V
n = M V
n = (0,4 mol / l) 0,5 1
= 0,2 mol
Att veta hur många mol kopparsulfat dess massa kan erhållas
n = m / PM
m = nmolekylär vikt
m = 0,2 mol 160 g / mol
= 32 g CuSO4
Det vill säga 32 gram av detta salt måste lösas i 500 ml lösningsmedel.
Problem 2
Vilken volym av en lösning som behövs så att när 0,4 mol löst löses upp har den en koncentration på 0,25 M?
Volymen av lösningen erhålls från begreppet molaritet
M = n / V
V = n / M
V = 0,4 mol / (0,25 mol / L)
= 1,6 L.
Det betyder att lösningen måste ha en volym på 1,6 liter för att uppnå en sådan koncentration på 0,25 M.
Problem 3
En massa av 8 g natriumhydroxid (NaOH) löses i 60 g av en lösning som har en densitet av 1,6 g / ml. Vad blir molariteten hos lösningen? Natriumhydroxidmolekylvikt: 40 g / mol.
Mol NaOH måste först beräknas:
n = m / PM
= 8 g natriumhydroxid / (40 g / mol)
= 0,2 mol
Nu fortsätter vi med att beräkna volymen på lösningen:
m = V d
v = 60 g / (1,6 g / ml)
v = 37,5 ml
För att få molariteten måste lösningsvolymen i liter placeras:
V = 37,5 ml 10-3 L / ml
= 0,0375 L.
M = 0,2 mol / 0,0375 L
5,33 mol / l
5,33 M
Problem 4
Beräkna molariteten för en saltsyralösning (HCl) med en densitet av 1,25 g / ml och en koncentration på 35%, uttryckt massa / massa. Saltsyramolekylvikt: 36,5 g / mol.
Bestäm massan av 35% saltsyra
m = V d
m = 1 000 ml 1,25 g / ml
= 1 250 g
Men inte allt är HCl, det finns också vatten:
massa HCl = 1 250 g (35/100)
= 437,5 g
Vilket är detsamma som att säga att det i en liter 35% HCl-lösning finns 437,5 gram HCl.
Därefter beräknas mol HCl för att omedelbart bestämma molariteten:
n = m / PM
n = (437,5 g / L) / (36,5 g / mol)
= 11,98 mol / l
Molaritet = 11,98 M
Problem 5
Beräkna molariteten för en lösning som innehåller 5 g NaCl i 2 liter lösning. Natriumkloridmolekylvikt: 58,5 g / mol.
Mol / l NaCl kan erhållas i ett enda steg:
molaritet = (5 g NaCl / 2 L lösning) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol / l
Molaritet = 0,043 M
Ett annat förfarande kan vara:
g / L NaCl = 5 g / 2 L
= 2,5 g / L.
mol / L = (2,5 g / L) / (58,5 g / mol)
= 0,043 mol / l
= 0,043 M
Referenser
- Rodríguez, M. (2007). Kemi. Salesian Editorial Foundation
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2019). Molaritet Återställd från: es.wikipedia.org
- Atarés Huerta. (s.f.). Molaritet och molalitet. [PDF]. Återställd från: riunet.upv.es
- Softchools. (2019). Molaritetsformel. Återställd från: softschools.com


Ingen har kommenterat den här artikeln än.