
Formler för Carnot-maskiner, hur det fungerar och applikationer

De carnot-maskin det är en idealisk cyklisk modell där värme används för att utföra arbete. Systemet kan förstås som en kolv som rör sig inuti en cylinder som komprimerar en gas. Cykeln som utövas är den av Carnot, förkunnad av termodynamikens far, den franska fysikern och ingenjören Nicolas Léonard Sadi Carnot..
Carnot förklarade denna cykel i början av 1800-talet. Maskinen utsätts för fyra variationer av tillstånd, alternerande förhållanden såsom temperatur och konstant tryck, där en variation av volymen framgår vid komprimering och expansion av gasen.
Artikelindex
- 1 Formler
- 1.1 Isotermisk expansion (A → B)
- 1.2 Adiabatisk expansion (B → C)
- 1.3 Isotermisk kompression (C → D)
- 1.4 Adiabatisk kompression (D → A)
- 2 Hur fungerar Carnot-maskinen?
- 3 applikationer
- 4 Referenser
Formler
Enligt Carnot är det möjligt att maximera den erhållna prestandan genom att utsätta den ideala maskinen för variationer i temperatur och tryck.
Carnot-cykeln måste analyseras separat i var och en av dess fyra faser: isotermisk expansion, adiabatisk expansion, isotermisk kompression och adiabatisk kompression..
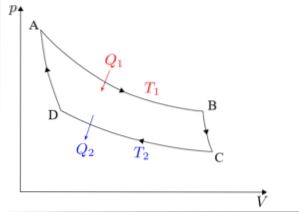
Formlerna associerade med var och en av faserna i cykeln som utförs i Carnots maskin kommer att beskrivas nedan..
Isotermisk expansion (A → B)
Lokalerna för denna fas är följande:
- Gasvolym: går från minsta volym till medelvolym.
- Maskintemperatur: konstant temperatur T1, högt värde (T1> T2).
- Maskintryck: sjunker från P1 till P2.
Den isotermiska processen innebär att temperaturen T1 inte varierar under denna fas. Värmeöverföring inducerar gasutvidgning, vilket inducerar rörelse på kolven och producerar mekaniskt arbete.
När gasen expanderar har den en tendens att svalna. Det absorberar emellertid värmen som avges av temperaturkällan och under dess expansion bibehåller den konstant temperatur..
Eftersom temperaturen förblir konstant under denna process ändras inte gasens inre energi och all värme som absorberas av gasen omvandlas effektivt till arbete. A) Ja:
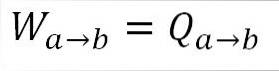
För sin del är det i slutet av denna fas av cykeln också möjligt att erhålla tryckvärdet med den ideala gasekvationen. Således har vi följande:
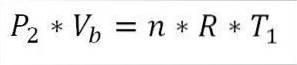
I detta uttryck:
Ptvå: Tryck i slutet av fasen.
Vb: Volym vid punkt b.
n: Antal mol gas.
A: Universalkonstant av idealgaser. R = 0,082 (atm * liter) / (mol * K).
T1: Initial absolut temperatur, grader Kelvin.
Adiabatisk expansion (B → C)
Under denna fas av processen sker gasutvidgning utan att det behöver bytas ut värme. Således beskrivs lokalerna nedan:
- Gasvolym: går från medelvolym till maximal volym.
- Maskintemperatur: sjunker från T1 till T2.
- Maskintryck: konstant tryck P2.
Den adiabatiska processen innebär att trycket P2 inte varierar under denna fas. Temperaturen sjunker och gasen fortsätter att expandera tills den når sin maximala volym; det vill säga kolven når stoppet.
I det här fallet kommer arbetet från gasens inre energi och dess värde är negativt eftersom energin minskar under denna process..
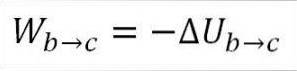
Förutsatt att det är en idealisk gas, säger teorin att gasmolekyler bara har kinetisk energi. Enligt principerna för termodynamik kan detta härledas med följande formel:
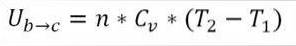
I denna formel:
∆Ub → c: Variation av den interna energin hos den ideala gasen mellan punkterna b och c.
n: Antal mol gas.
Cv: Molär värmekapacitet för gas.
T1: Initial absolut temperatur, grader Kelvin.
T2: Absolut slutstemperatur, grader Kelvin.
Isotermisk kompression (C → D)
I denna fas börjar kompressionen av gasen; det vill säga kolven rör sig in i cylindern, med vilken gasen kontraherar sin volym.
Villkoren som ligger bakom denna fas av processen beskrivs nedan:
- Gasvolym: går från maximal volym till mellanvolym.
- Maskintemperatur: konstant temperatur T2, reducerat värde (T2 < T1).
- Maskintryck: ökar från P2 till P1.
Här ökar trycket på gasen så att den börjar komprimera. Emellertid förblir temperaturen konstant och därför är variationen av intern energi hos gasen noll.
Analogt med isotermisk expansion är det utförda arbetet lika med systemets värme. A) Ja:
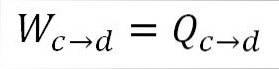
Det är också möjligt att hitta trycket vid denna punkt med den ideala gasekvationen.
Adiabatisk kompression (D → A)
Det är den sista fasen av processen, där systemet återgår till sina ursprungliga förhållanden. För detta beaktas följande villkor:
- Gasvolym: går från en mellanvolym till en lägsta volym.
- Maskintemperatur: ökar från T2 till T1.
- Maskintryck: konstant tryck P1.
Värmekällan som införlivades i systemet i föregående fas avlägsnas så att den ideala gasen höjer sin temperatur så länge trycket förblir konstant..
Gasen återgår till de ursprungliga temperaturförhållandena (T1) och till dess volym (minimum). Återigen kommer arbetet från den inre energin i gasen, så du måste:
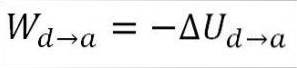
I likhet med fallet med adiabatisk expansion är det möjligt att erhålla variationen av gasenergin med hjälp av följande matematiska uttryck:
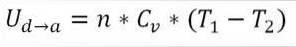
Hur fungerar Carnot-maskinen?
Carnot-motorn fungerar som en motor där prestanda maximeras genom att variera isotermiska och adiabatiska processer, alternerande expansions- och kompressionsfaserna för en idealgas..
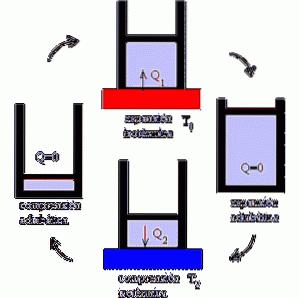
Mekanismen kan förstås som en idealisk enhet som utför arbete som utsätts för värmevariationer, med tanke på att det finns två temperaturkällor.
I det första fokuset utsätts systemet för en temperatur T1. Det är en hög temperatur som belastar systemet och får gasen att expandera..
I sin tur översätts detta till utförandet av ett mekaniskt arbete som möjliggör mobilisering av kolven ur cylindern, och vars stopp endast är möjligt genom adiabatisk expansion.
Sedan kommer det andra fokuset, där systemet utsätts för en temperatur T2, lägre än T1; det vill säga mekanismen utsätts för kylning.
Detta inducerar extraktion av värme och krossning av gasen, som når sin ursprungliga volym efter adiabatisk kompression..
Applikationer
Carnot-maskinen har använts i stor utsträckning tack vare dess bidrag till att förstå de viktigaste aspekterna av termodynamik.
Denna modell möjliggör en klar förståelse av variationerna hos ideala gaser som är föremål för förändringar i temperatur och tryck, vilket gör den till en referensmetod när man utformar riktiga motorer..
Referenser
- Carnot Heat Engine Cycle and the 2nd Law (s.f.). Återställd från: nptel.ac.in
- Castellano, G. (2018). Carnot-maskin. Återställd från: famaf.unc.edu.ar
- Carnot cykel (s.f.) Ecured. Havanna Kuba. Återställd från: ecured.cu
- Carnot-cykeln (s.f.). Återställd från: sc.ehu.es
- Fowler, M. (s.f.). Värmemotorer: Carnot-cykeln. Återställd från: galileo.phys.virginia.edu
- Wikipedia, The Free Encyclopedia (2016). Carnot-maskin. Återställd från: es.wikipedia.org



Ingen har kommenterat den här artikeln än.