
Formler, egenskaper, användningsområden och risker av aluminiumnitrat
De aluminiumnitrat Det är aluminiumsaltet av salpetersyra. Aluminiumnitrat nonahydrat, vid rumstemperatur, verkar som ett färglöst fast ämne med lukten av salpetersyra..
De är inte brännbara, men de kan påskynda förbränningen av brännbara material. Om stora mängder aluminiumnitrat är inblandade eller om brännbart material delas fint kan en explosion inträffa..

Långvarig exponering för eld eller värme kan leda till en explosion. När de kommer i kontakt med eld producerar de kväveoxider. Dess användning inkluderar raffinering av petroleum och färgning och garvning av läder..
Det är ett vitt, vattenlösligt salt som oftast förekommer i sin kristallina nonahydratform (aluminiumnitrat nonahydrat)..
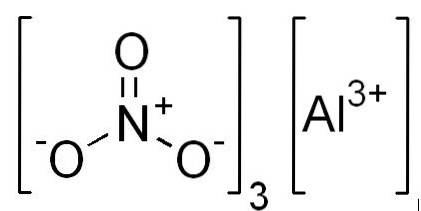
Artikelindex
- 1 Formler
- 2 Struktur
- 2.1 I 2D
- 2.2 I 3D
- 3 Fysikaliska och kemiska egenskaper
- 3.1 Reaktivitetsvarningar
- 3.2 Reaktioner med luft och vatten
- 3.3 Antändlighet
- 3.4 Reaktivitet
- 3.5 Toxicitet
- 4 användningsområden
- 5 Kliniska effekter
- 6 Säkerhet och risker
- 6.1 GHS-faroklasser
- 6.2 Skyddsangivelsekoder
- 7 Referenser
Formler
- Aluminiumnitrat: Al (NO3)3
- Aluminiumnitrat nonahydrat: Al (NO3)3 9HtvåELLER
- CAS: 13473-90-0 Aluminiumnitrat (vattenfritt)
- CAS: 14797-65-0 Aluminiumnitrat (nonahydrat)
Strukturera
I 2D
I 3d
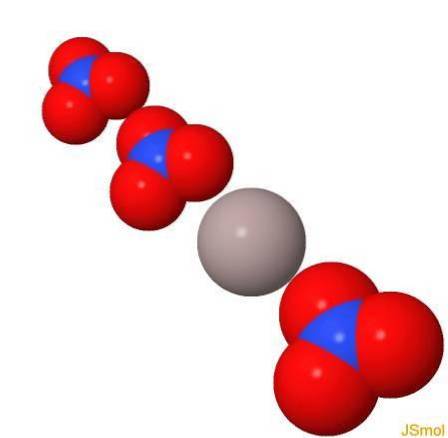
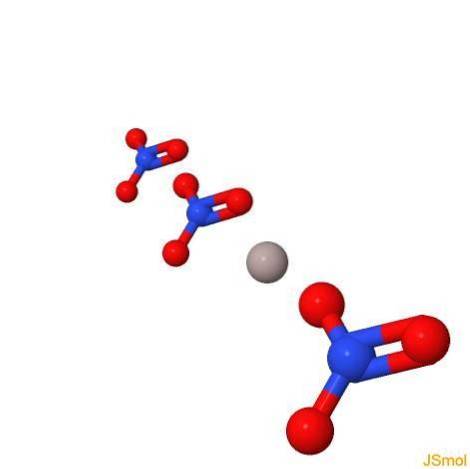
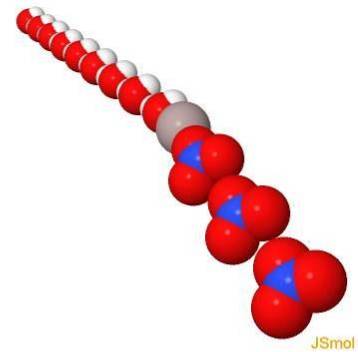
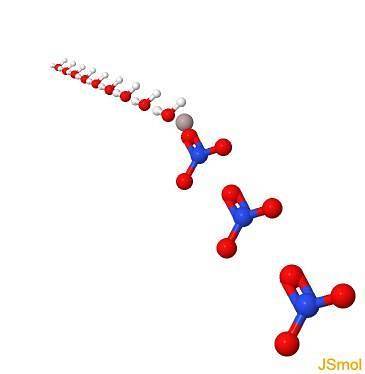
Fysiska och kemiska egenskaper
- Aluminiumnitrat tillhör den reaktiva gruppen av oorganiska nitrat- och nitritföreningar.
- Nitratjonen är en polyatomisk jon med molekylformeln NO3 - och är konjugatbasen av salpetersyra.
- Nästan alla oorganiska nitratsalter är lösliga i vatten vid standardtemperatur och -tryck..
- Nitratföreningar har ett brett användningsområde baserat på deras aktivitet som oxidationsmedel, närvaron av fritt tillgängligt kväve eller deras höga löslighet..
Reaktivitetsvarningar
Aluminiumnitrat är ett starkt oxidationsmedel.
Reaktioner med luft och vatten
Aluminiumnitrat är torkande (det har egenskapen att absorbera fukt från luften för att bilda en vattenlösning). Det är lösligt i vatten. Dess vattenlösningar är sura.
Eldfarlighet
Nitrater och nitriter är explosiva föreningar. Vissa av dessa ämnen kan sönderdelas explosivt vid uppvärmning eller brand. De kan explodera från värme eller föroreningar. Behållare kan explodera vid uppvärmning.
Särskilda faror från förbränningsprodukter: giftiga kväveoxider kan bildas vid brand med aluminiumnitrat.
Reaktivitet
Nitrater och nitriter kan fungera som extremt kraftfulla oxidationsmedel och blandningar med reduktionsmedel eller reducerade material såsom organiska ämnen kan vara explosiva. Reagera med syror för att bilda giftig kvävedioxid.
I allmänhet är nitrat- och nitritsalter med redoxaktiva katjoner (övergångsmetaller och metallerna i grupp 3a, 4a och 5a i det periodiska systemet, liksom ammoniumkatjonen [NH4] +) mer reaktiva med organiska material och medel. under omgivande förhållanden.
Aluminiumnitrat är ett oxidationsmedel. Blandningar med alkylestrar kan explodera. Blandningar med fosfor, tenn (II) klorid eller andra reduktionsmedel kan reagera explosivt.
Giftighet
Människor utsätts för nitrat- och nitritstoxicitet, och barn är särskilt utsatta för metemoglobinemi.
Förtäring av stora doser aluminiumnitrat orsakar magirritation, illamående, kräkningar och diarré. Kontakt med damm irriterar ögon och hud.
Applikationer
Nitrater och nitriter används i stor utsträckning (och i mycket stora mängder) som gödningsmedel i jordbruket på grund av deras vilja att bryta ner och släppa ut kväve för växttillväxt och på grund av deras löslighet, vilket gör att nitratjoner kan absorberas av växtens rötter.
Nitratföreningar används också i stor utsträckning som ett industriellt råmaterial när ett oxidationsmedel eller nitratjonkälla krävs..
Aluminiumnitrat används vid tillverkning av laboratorie-, kosmetiska och personliga hygienkemikalier. Inom industrin används den som mellanprodukt vid tillverkning av andra ämnen.
Det används vid garvning av läder, i antiperspiranter, korrosionsinhibitorer, uranutvinning, petroleumraffinering och som nitreringsmedel..
Aluminiumnitrat nonahydrat och andra hydratiserade aluminiumnitrater har många tillämpningar. Dessa salter används för att framställa aluminiumoxid för framställning av isolerande papper, i värmeelement i katodstrålerör och i transformatorns kärllaminat. Hydrerade salter används också för extraktion av aktinidiska element.
Kliniska effekter
Aluminium är allestädes närvarande, det är den vanligaste metallen i jordskorpan. Mest mänsklig exponering kommer från mat. Det finns i vissa farmaceutiska produkter. Inom industrin används det ofta.
Aluminium hämmar benrenovering och orsakar osteomalacia. Det antas hämma erytropoies och orsaka anemi.
Akut förgiftning är sällsynt. Lösliga former av aluminium har större potential för toxicitet än olösliga former på grund av deras större absorption..
Patienter med njursvikt är benägna att aluminiumtoxicitet, antingen från aluminium i dialysatet eller andra exogena källor, särskilt fosfatbindemedel och aluminiuminnehållande antacida..
Kronisk exponering för aluminiumdamm kan orsaka dyspné, hosta, lungfibros, pneumothorax, pneumokonios, encefalopati, svaghet, inkoordination och epileptiforma anfall..
Aluminiumsalter kan orsaka irritation i ögon och slemhinnor, konjunktivit, dermatos och eksem..
Även om aluminium och dess föreningar har visat lite bevis på cancerframkallande effekter hos människor, har exponering för andra ämnen som är involverade i aluminiumproduktion associerats med cancerframkallande egenskaper..
Säkerhet och risker
Faroangivelser från det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS).
Det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS) är ett internationellt överenskommet system, skapat av FN och utformat för att ersätta de olika klassificerings- och märkningsstandarder som används i olika länder genom att använda enhetliga kriterier globalt..
Faroklasserna (och deras motsvarande kapitel i GHS), klassificerings- och märkningsstandarderna och rekommendationerna för aluminiumnitrat och för aluminiumnitrat-nonahydrat är följande (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):
GHS-faroklasser
H272: Kan intensifiera eld; Oxidizer [Varning Oxiderande vätskor; Oxiderande fasta ämnen - Kategori 3] (PubChem, 2017).
H301: Giftigt vid förtäring [Akut toxicitetsrisk, oral - kategori 3] (PubChem, 2017).
H315: Orsakar hudirritation [Varning Frätning / irritation av hud - Kategori 2] (PubChem, 2017).
H318: Orsakar allvarlig ögonskada [Fara Allvarlig ögonskada / ögonirritation - Kategori 1] (PubChem, 2017).
H319: Orsakar allvarlig ögonirritation [Varning Allvarlig ögonskada / ögonirritation - Kategori 2A] (PubChem, 2017).
Skyddsangivelsekoder
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405, och (PubChem, 2017).





Referenser
- ChemIDplus (2017) 3D-struktur av 13473-90-0 - Aluminiumnitrat [bild] Återställd från: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-struktur av 7784-27-2 - Aluminiumnitrat nonahydrat [bild] Återställd från: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [image] Återställd från: flickr.com.
- Edgar181 (2008) Aluminiumnitrat [bild]. Återställd från: wikipedia.org.
- Europeiska kemikaliemyndigheten (ECHA). (2016). Aluminiumnitrat. Kort profil. Hämtad den 8 februari 2017 från echa.europa.eu.
- Databank för farliga ämnen (HSDB). TOXNET. (2017). Aluminiumnitrat. Bethesda, MD, EU: National Library of Medicine. Återställd från: chem.nlm.nih.gov.
- JSmol (2017) Nitrat [bild] Återställd från: chemapps.stolaf.edu.
- Wikipedia. (2017). Aluminiumnitrat. Hämtad 8 februari 2017 från: wikipedia.org.
- Wikipedia. (2017). Aluminiumnitrat nonahydrat. Hämtad 8 februari 2017 från: wikipedia.org.


Ingen har kommenterat den här artikeln än.