
Kvicksilverhydroxidstruktur, egenskaper, användningsområden, risker

De kvicksilverhydroxid Det är en oorganisk förening där metallkvicksilver (Hg) har ett oxidationsnummer på 2+. Dess kemiska formel är Hg (OH)två. Emellertid har denna art ännu inte erhållits i fast form under normala förhållanden..
Kvicksilverhydroxid eller kvicksilverhydroxid är en kortvarig övergående mellanprodukt vid bildning av kvicksilveroxid HgO i alkalisk lösning. Från studier utförda i lösningar av kvicksilveroxid HgO har man dragit slutsatsen att Hg (OH)två det är en svag bas. Andra arter som följer med det är HgOH+ och Hgtvå+.

Trots att man inte kan fällas ut i vattenlösning, Hg (OH)två Det har erhållits genom fotokemisk reaktion av kvicksilver med väte och syre vid mycket låga temperaturer. Det har också erhållits i form av en samutfällning tillsammans med Fe (OH)3, där närvaron av halidjoner påverkar pH vid vilket samutfällning sker.
Eftersom det inte enkelt har uppnåtts rent på laboratorienivå har det inte varit möjligt att hitta någon användning för denna förening eller att bestämma riskerna med dess användning. Man kan dock dra slutsatsen att den utgör samma risker som de andra kvicksilverföreningarna.
Artikelindex
- 1 Molekylens struktur
- 2 Elektronisk konfiguration
- 3 Nomenklatur
- 4 fastigheter
- 4.1 Molekylvikt
- 4.2 Kemiska egenskaper
- 5 Skaffa
- 5.1 Ren kvicksilverhydroxid
- 5.2 Samutfällning med järn (III) hydroxid
- 6 användningsområden
- 7 Nya studier
- 8 risker
- 9 Referenser
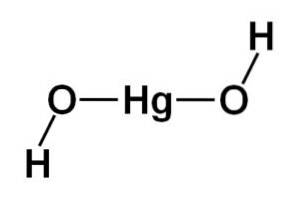
Molekylens struktur
Strukturen av kvicksilver (II) hydroxid Hg (OH)två den är baserad på en linjär central del bildad av kvicksilveratomen med de två syreatomerna på sidorna.
Väteatomer är fästa vid denna centrala struktur, vardera bredvid varje syre, som roterar fritt runt varje syre. Det kan representeras på ett enkelt sätt enligt följande:
Elektronisk konfiguration
Den elektroniska strukturen för metalliskt kvicksilver Hg är som följer:
[Xe] 5d10 6stvå
där [Xe] är elektronkonfigurationen för ädelgas-xenon.
När man observerar denna elektroniska struktur härleds att det mest stabila oxidationstillståndet för kvicksilver är det där de 2 elektronerna i skikt 6 går förlorade.s.
I kvicksilverhydroxid Hg (OH)två, kvicksilveratomen (Hg) är i dess 2+ oxidationstillstånd. Därför i Hg (OH)två kvicksilver har följande elektroniska konfiguration:
[Xe] 5d10
Nomenklatur
- Kvicksilver (II) hydroxid
- Kvicksilverhydroxid
- Kvicksilver-dihydroxid
Egenskaper
Molekylvikt
236,62 g / mol
Kemiska egenskaper
Enligt den information som konsulterats är det möjligt att Hg (OH)två vara en övergående förening vid bildning av HgO i alkaliskt vattenhaltigt medium.
Tillsatsen av hydroxyljoner (OH-till en vattenlösning av kvicksilverjoner Hgtvå+ leder till utfällning av ett gult fast ämne av kvicksilver (II) oxid HgO, varav Hg (OH)två är tillfällig eller tillfällig agent.

I vattenlösning Hg (OH)två Det är en mycket kortlivad mellanprodukt, eftersom den snabbt släpper ut en vattenmolekyl och fast HgO-fällning.
Även om det inte har varit möjligt att fälla ut kvicksilverhydroxid Hg (OH)två, kvicksilver (II) oxid HgO är något lösligt i vatten och bildar en lösning av arter som kallas "hydroxider".
Dessa arter i vatten som kallas "hydroxider" är svaga baser och, även om de ibland beter sig som amfotera, i allmänhet Hg (OH)två den är mer basisk än syra.
När HgO löser sig i HClO4 studier indikerar närvaron av kvicksilverjon Hgtvå+, en monohydroxikurkurjonjon HgOH+ och kvicksilverhydroxid Hg (OH)två.
Jämvikten som förekommer i sådana vattenlösningar är som följer:
Hgtvå+ + HtvåO ⇔ HgOH+ + H+
HgOH+ + HtvåO ⇔ Hg (OH)två + H+
I alkaliska lösningar av NaOH bildas arten Hg (OH)3-.
Erhållande
Ren kvicksilverhydroxid
Kvicksilver (II) hydroxid Hg (OH)två Det kan inte erhållas i vattenlösning, för när alkali tillsätts till en lösning av kvicksilverjoner Hgtvå+, gul kvicksilveroxid HgO fälls ut.
Men vissa forskare lyckades få kvicksilverhydroxid Hg (OH) för första gången 2005två med en kvicksilverbågslampa, med utgångspunkt från grundämnet kvicksilver Hg, väte Htvå och syre Otvå.

Reaktionen är fotokemisk och utfördes i närvaro av fast neon, argon eller deuterium vid mycket låga temperaturer (cirka 5 K = 5 grader Kelvin). Bevis på bildning av föreningar erhölls med IR (infraröd) ljusabsorptionsspektra.
Hg (OH)två förberedd på detta sätt är det mycket stabilt under erfarenhetsförhållandena. Det uppskattas att den fotokemiska reaktionen fortskrider genom mellanprodukten O-Hg-O till den stabila molekylen H-O-Hg-O-H.
Samutfällning med järn (III) hydroxid
Om kvicksilver (II) sulfat HgSO löses upp4 och järn (III) sulfat Fetvå(SW4)3 i sur vattenlösning, och pH börjar öka genom tillsats av en lösning av natriumhydroxid NaOH, efter stående tid bildas ett fast ämne som härleds till att vara en samutfällning av Hg (OH)två och Fe (OH)3.
Man har funnit att bildandet av Hg (OH)två är ett kritiskt steg i denna samutfällning med Fe (OH)3.
Bildandet av Hg (OH)två i fällningen Fe (OH)3-Hg (OH)två beror starkt på närvaron av joner såsom fluorid, klorid eller bromid, på deras specifika koncentration och på pH i lösningen.
I närvaro av fluor (F-vid pH större än 5, samutfällningen av Hg (OH)två med Fe (OH)3 det påverkas inte. Men vid ett pH på 4 bildas komplex mellan Hgtvå+ och F- stör samutfällningen av Hg (OH)två.
I fallet med närvaro av klorid (Cl-samutfällning av Hg (OH)två uppträder vid ett pH av 7 eller högre, det vill säga företrädesvis i ett alkaliskt medium.
När bromid (Br-samutfällning av Hg (OH)två uppträder vid ännu högre pH, det vill säga pH över 8,5, eller mer alkaliskt än med klorid.
Applikationer
Från granskningen av tillgängliga informationskällor dras slutsatsen att kvicksilver (II) hydroxid Hg (OH)två, Att vara en förening som ännu inte framställts kommersiellt har den inga kända användningsområden.
Nyliga studier
Med hjälp av beräkningssimuleringstekniker 2013 studerades de strukturella och energiska egenskaperna relaterade till hydrering av Hg (OH).två i gasform.
Metall-ligandkoordination och solvensenergier beräknades och jämfördes genom att variera graden av hydrering av Hg (OH)två.
Bland annat fann man att uppenbarligen är det teoretiska oxidationstillståndet 1+ istället för det antagna 2+ vanligtvis tilldelat för Hg (OH)två.
Risker
Även om Hg (OH)två som sådan har den inte isolerats i tillräcklig mängd och har därför inte använts kommersiellt, dess specifika risker har inte fastställts, men man kan dra slutsatsen att den utgör samma risker som resten av kvicksilversalter.
Det kan vara giftigt för nervsystemet, matsmältningssystemet, huden, ögonen, andningsorganen och njurarna..
Inandning, intag eller kontakt med huden av kvicksilverföreningar kan orsaka skador från ögon- och hudirritation, sömnlöshet, huvudvärk, skakningar, tarmkanalen, minnesförlust, till njursvikt, bland andra symtom.
Kvicksilver har erkänts internationellt som förorening. De flesta kvicksilverföreningar som kommer i kontakt med miljön metyleras av bakterier som finns i jord och sediment och bildar metylkvicksilver..
Denna förening bioackumuleras i levande organismer, som går från jorden till växter och därifrån till djur. I vattenmiljön är överföringen ännu snabbare, går från mycket små till stora arter på kort tid.
Metylkvicksilver har en toxisk effekt för levande varelser och i synnerhet för människor som äter det genom livsmedelskedjan.
När det intas med mat är det särskilt skadligt för små barn och foster hos gravida kvinnor, eftersom det är ett neurotoxin kan det orsaka skada på hjärnan och nervsystemet i bildning och tillväxt..
Referenser
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Wang, Xuefeng och Andrews, Lester (2005). Infrarött spektrum av Hg (OH)två i Solid Neon och Argon. Oorganisk kemi, 2005, 44, 108-113. Återställd från pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Vattenlösning av Hg (OH)två: Energetiska och dynamiska densitetsfunktionella teoristudier av Hg (OH)två-(HtvåELLER)n (n = 1-24) Strukturer. J. Phys. Chem. A 2013, 117, 9069-9075. Återställd från pubs.acs.org.
- Inoue, Yoshikazu och Munemori, Makoto. (1979). Samutfällning av kvicksilver (II) med järn (III) hydroxid. Miljövetenskap och teknik. Volym 13, nummer 4, april 1979. Återställd från pubs.acs.org.
- Chang, L.W., et al. (2010). Nervsystemet och beteendetoxikologi. I omfattande toxikologi. Återställd från sciencedirect.com.
- Haney, Alan och Lipsey, Richard L. (1973). Ackumulering och effekter av metylkvicksilverhydroxid i en markbunden livsmedelskedja under laboratorieförhållanden. Miljö. Förorena. (5) (1973) s. 305-316. Återställd från sciencedirect.com.



Ingen har kommenterat den här artikeln än.