
Kalciumnitrat (Ca (NO3) 2) struktur, egenskaper och användningsområden

De kalciumnitrat är ett tertiärt oorganiskt salt vars kemiska formel är Ca (NO3)två. Från dess formel är det känt att dess fasta ämne består av Ca-jonertvå+ och nej3- i förhållandet 1: 2. Därför är det en förening av rent jonisk natur..
En av dess egenskaper är dess oxiderande karaktär på grund av nitratanjonen. Det är inte brännbart, det vill säga det brinner inte vid höga temperaturer. Eftersom det inte är brännbart, representerar det ett säkert fastämne att hantera utan mycket omsorg; det kan dock påskynda antändningen av brännbara material.

Dess utseende består av ett granulärt fast ämne som har en vit eller ljusgrå färg (övre bild). Det kan vara vattenfritt eller tetrahydrat, Ca (NO3)två4HtvåO. Det är mycket lösligt i vatten, metanol och aceton.
Kalciumnitrat har använts i stor utsträckning som gödningsmedel, eftersom det färdas lätt i fuktig jord och absorberas snabbt av växtrötter. Ger två viktiga element för växtnäring och tillväxt: kväve och kalcium.
Kväve är ett av de tre väsentliga elementen för utveckling av växter (N, P och K), det är viktigt vid syntes av proteiner. Under tiden är kalcium nödvändigt för att bibehålla strukturen i växtcellväggen. Av denna anledning Ca (NO3)två mycket går till trädgårdar.
Å andra sidan har detta salt giftiga verkningar, särskilt genom direkt kontakt med huden och ögonen, liksom genom att andas in dess damm. Dessutom kan den sönderdelas genom uppvärmning.
Artikelindex
- 1 Struktur av kalciumnitrat
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Kemiska namn
- 2.2 Molekylformel
- 2.3 Molekylvikt
- 2.4 Fysiskt utseende
- 2.5 Kokpunkt
- 2.6 Smältpunkt
- 2.7 Löslighet i vatten
- 2.8 Löslighet i organiska lösningsmedel
- 2.9 Surhet (pKa)
- 2.10 Densitet
- 2.11 Sönderfall
- 2.12 Reaktiv profil
- 3 användningsområden
- 3.1 Jordbruk
- 3.2 Betong
- 3.3 Avlopps- eller avloppsrening
- 3.4 Gör kalla kompresser
- 3.5 Latexkoagulation
- 3.6 Värmeöverföring och lagring
- 4 Ansökningsformer
- 5 Referenser
Struktur av kalciumnitrat
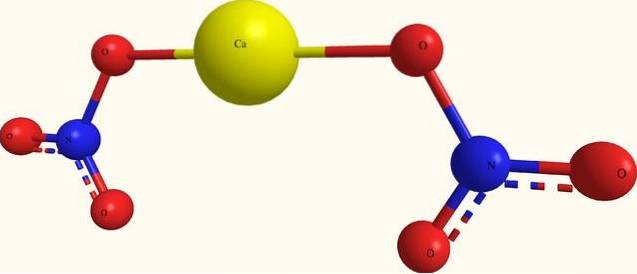
Den övre bilden visar strukturen för Ca (NO3)två i en modell av sfärer och stänger. Här finns emellertid en brist: förekomsten av kovalenta Ca-O-bindningar antas, vilket strider mot deras joniska karaktär. För att klargöra detta är interaktionerna verkligen av elektrostatisk typ.
Katjonen Catvå+ omger sig med två NO anjoner3- enligt dess proportioner på glaset. Därför dominerar kväve i form av nitrat i den kristallina strukturen..
Jonerna är grupperade på ett sådant sätt att de skapar en konfiguration vars minsta uttryck är enhetscellen; vilket för det vattenfria saltet är kubiskt. Det vill säga, från kuber som innehåller förhållandet 1: 2 för dessa joner reproduceras hela kristallen.
Å andra sidan är tetrahydratsaltet, Ca (NO3)två4HtvåEller så har den fyra vattenmolekyler för varje uppsättning NO3- ACtvå+ INTE3-. Detta modifierar kristallstrukturen och deformerar den till en monoklinisk enhetscell..
Därför förväntas kristallerna för både de vattenfria och tetrahydrat-salterna vara olika; skillnader som kan bestämmas i deras fysiska egenskaper, till exempel smältpunkter.
Fysiska och kemiska egenskaper
Kemiska namn
-Kalciumnitrat
-Kalciumdinitrat
-Nitrocalcite
-Norsk saltpeter och limesaltpetro.
Molekylär formel
Pip3)två eller CaNtvåELLER6
Molekylvikt
Vattenfri 164,088 g / mol och tetrahydrat 236,15 g / mol. Observera vattenets inverkan på molekylvikten och det kan inte försummas när man väger det..
Fysiskt utseende
Vit eller ljusgrå fast eller granulat. Kubiska vita kristaller eller krympande granulat; det vill säga de absorberar fukt till den punkt att de löses upp som ett resultat av deras höga löslighet.
Kokpunkt
Den vattenfria formen sönderdelas vid upphettning till en temperatur som förhindrar bestämning av dess kokpunkt; medan tetrahydratformen av saltet har en kokpunkt på 132 ° C (270ºF, 405K).
Smältpunkt
-Vattenfri form: 561 ° C till 760 mmHg (1042 ° F, 834 K).
-Tetrahydratform: 42,7 ° C (109 ° F, 316 K).
Detta visar hur vattenmolekyler stör elektrostatiska interaktioner mellan Catvå+ och nej3- inuti kristallerna; och följaktligen smälter fastämnet vid en mycket lägre temperatur.
Vattenlöslighet
-Vattenfri form: 1212 g / L vid 20 ºC.
-Tetrahydratform: 1290 g / L vid 20 ºC.
Vattnet i kristallerna ökar knappast saltets löslighet.
Löslighet i organiska lösningsmedel
-I etanol, 51,42 g / 100 g vid 20 ° C.
-I metanol, 134 g / 100 g vid 10 ° C.
-I aceton, 168 g / 100 g vid 20 ° C.
Surhet (pKa)
6.0
Densitet
2,5 g / cm3 vid 25 ºC (tetrahydrat).
Sönderfall
När kalciumnitrat värms upp till glöd, sönderdelas det i kalciumoxid, kväveoxid och syre..
Reaktiv profil
Det är ett starkt oxiderande ämne, men det är inte brännbart. Påskyndar antändningen av brännbara material. Uppdelningen av kalciumnitrat i fina partiklar underlättar dess explosion när föreningen utsätts för långvarig eld.
Blandningar med alkylestrar blir explosiva genom att de härrör från alkylnitratestrar. Kombinationen av kalciumnitrat med fosfor, tenn (II) klorid eller annat reduktionsmedel kan reagera explosivt.
Applikationer
jordbruk
Det används i grödor som en kväve- och kalckkälla. Kalciumnitrat är mycket lösligt i vatten och absorberas lätt av växtrötter. Dessutom försurar den inte jord eftersom dess joner inte kan hydrolyseras avsevärt..
Blandning med gödselmedel som innehåller fosfor eller sulfat bör undvikas för att undvika bildning av olösliga salter. På grund av dess hygroskopicitet bör den förvaras i en torr och sval miljö.
Dess användning har en fördel framför användningen av ammoniumnitrat som gödningsmedel. Även om denna sista förening bidrar med kväve till växter stör den kalciumabsorptionen, vilket kan leda till kalciumbrist i växter..
Kalcium bidrar till att upprätthålla växternas cellväggsstruktur. I närvaro av kalciumbrist uppvisar växande vävnader av växter, såsom rotspetsar, unga löv och spetsspetsar, förvrängd tillväxt..
Minskad ammoniak
Kalciumnitrat minskar ansamlingen av flyktiga fettsyror och fenolföreningar, fytotoxiska som ackumuleras på grund av nedbrytning av sojabönor.
Dessutom finns det en tendens för kalciumnitrat att minska ammoniumkoncentrationen i jorden, vilket ökar vätebuffertkapaciteten..
Betong
Kalciumnitrat används för att minska betongens härdningstid. Detta produceras genom alstring av kalciumhydroxid, kanske genom en dubbelförskjutningsreaktion..
Dessutom inducerar kalciumnitrat genereringen av järnhydroxidföreningen, vars skyddande verkan på betong minskar korrosionen. Det vill säga det järn som finns kan reagera med de grundläggande komponenterna i betong, såsom kalciumhydroxid i sig..
Kalciumnitrat minskar härdningstiden, såväl som betongens motstånd, till vilken vulkanaska har tillsatts. För att studera effekten av att tillsätta kalciumnitrat till betong har ökande koncentrationer av kalciumnitrat använts, mellan 2% och 10%..
En större minskning av härdningstiden har observerats, liksom en ökning av betonghållfastheten då kalciumnitratkoncentrationen ökade upp till 10%.
Avlopps- eller avloppsrening
Kalciumnitrat används för att minska lukt från avloppsvatten genom att minska produktionen av vätesulfid. Dessutom konsumeras det organiska materialet som genererar anaeroba förhållanden, vilket gör det svårt för många biologiska arter att överleva..
Gör kalla kompresser
Kalciumnitrattetrahydrat är en endotermisk förening, det vill säga den har förmågan att absorbera värme från den omgivande miljön. Detta ger en kylning av kropparna som kommer i kontakt med behållarna som innehåller den..
Kompresserna ökar temperaturen och för att regenerera dem räcker det att placera dem i en frys
Latexkoagulation
Kalciumnitrat används i latexkoagulationsfasen. Det är en del av nedsänkningslösningen, och när den kommer i kontakt med lösningen som innehåller latex bryter den sin stabilisering och orsakar dess koagulering..
Värmeöverföring och lagring
Den binära blandningen av smält nitratsalter, inklusive kalcium med andra nitrater, används istället för termisk olja i solkraftverk för värmeöverföring och lagring.
Ansökningsformer
-Kalciumnitrat appliceras blandat med jorden i en koncentration av 1,59 kg per 30,48 mtvå, med tillräcklig vattning. Kalciumnitrat solubiliseras i vatten, vilket möjliggör absorption av plantans rötter. I hydroponiska grödor löses det upp i växande vatten.
-Kalciumnitrat används också i form av en spray för att spraya löv och blommor, vilket är en effektiv behandling för att förhindra ruttning av tomatblomman, korkfläcken och äpplets bittra grop..
-En mängd kalciumnitrat tillsätts till den betongbildande blandningen (cement, sand, stenar och vatten) och den effekt som dess tillsats har på betongens specifika egenskaper bestäms; som att ställa in hastighet och styrka.
-Kalciumnitrat tillsätts i en lämplig koncentration för att minska lukt från avloppsvatten eller avloppsvatten, till en nivå som lukt är acceptabelt för människor.
Referenser
- Bonnie L. Grant. (2019). Kalciumnitratgödselmedel - Vad gör kalciumnitrat för växter. Återställd från: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. och Vyn, T.J. (1990). Användningen av kalciumnitrat för att minska fytotoxinackumulering under nedbrytning av kroppsrester. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. och Hassan, I.O. (2011). Effekt av tillsats av kalciumnitrat på selektiva egenskaper hos betong som innehåller vulkanaska. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Kalciumnitrat. Återställd från: en.wikipedia.org
- Shiqi Dong & kol. (2018). Hämning av korrosion av stål av kalciumnitrat i halogenberikade kompletteringsvätska. npj Material Nedbrytningsvolym 2, Artikelnummer: 32.
- Emaginationz Technologies. (2019). Specifikationer för kalciumnitrat. Återställd från: direct2farmer.com
- PubChem. (2019). Kalciumnitrat. Återställd från: pubchem.ncbi.nlm.nih.gov

Ingen har kommenterat den här artikeln än.