
Magnesiumnitrat (Mg (NO3) 2) struktur, egenskaper, användningsområden

De magnesiumnitrat är en oorganisk fast substans vars kemiska formel är Mg (NO3)två. Det är en jonförening bildad genom förening av en magnesiumkation Mgtvå+ och två nitratanjoner NO3-.
Mg (NO3)två det är ett vitt kristallint fast ämne. Det är mycket hygroskopiskt, det vill säga det absorberar lätt vatten från miljön. När den förblir i kontakt med den omgivande luften tenderar den att bilda sitt Mg-hexahydrat (NO3)två•6HtvåELLER.

Magnesiumnitrat Hexahydrat Mg (NO3)två•6HtvåO har i sin kristallstruktur 6 molekyler vatten HtvåEller för varje molekyl Mg (NO3)två. Magnesiumnitrat finns i grottor och gruvor i form av mineralet nitromagnesit.
Mg (NO3)två erhålls kommersiellt genom att reagera magnesiummetall Mg med salpetersyra HNO3.
Den har en mängd olika användningsområden, till exempel inom jordbruket som gödningsmedel eftersom det ger näringsämnen för växter som kväve (N) och magnesium (Mg)..
Det används i fyrverkerier eller pyroteknisk industri och även för att erhålla koncentrerad salpetersyra. Används i kemisk analys, fysikförsök och medicinska och vetenskapliga studier.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 3.7 Effekt av uppvärmning
- 4 Skaffa
- 4.1 Plats i naturen
- 5 användningsområden
- 5.1 I senare studier
- 5.2 I sjukdomsstudier
- 6 Referenser
Strukturera
Vattenfritt magnesiumnitrat består av en magnesiumkation Mgtvå+ och två nitratanjoner NO3-.
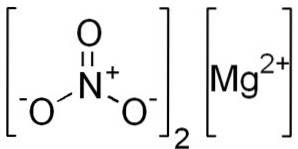
Magnesiumjon Mgtvå+ har elektronkonfiguration: 1stvå, 2stvå 2 s6, 3s0, eftersom det har gett de två elektronerna i det yttersta skalet (3s). Denna konformation är mycket stabil.
NO-jonen3- har en platt och symmetrisk struktur.
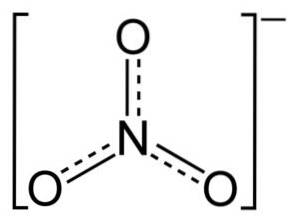
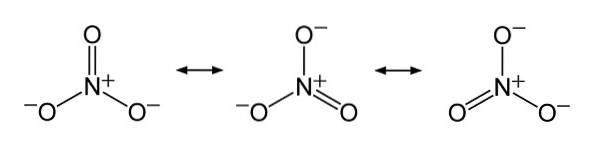
I strukturen av NO3- den negativa laddningen fördelas kontinuerligt mellan de tre syreatomerna.
Nomenklatur
-Vattenfritt magnesiumnitrat: Mg (NO3)två
-Magnesiumnitratdihydrat: Mg (NO3)två•2HtvåELLER
-Magnesiumnitrathexahydrat: Mg (NO3)två•6HtvåELLER
-Magnesium dinitrat
Egenskaper
Fysiskt tillstånd
-Mg (NO3)två vattenfri: vita fasta, kubiska kristaller.
-Mg (NO3)två dihydrat: vitt kristallint fast ämne.
-Mg (NO3)två hexahydrat: färglösa fasta, monokliniska kristaller
Molekylvikt
-Mg (NO3)två vattenfri: 148,31 g / mol
-Mg (NO3)två hexahydrat: 256,41 g / mol
Smältpunkt
-Mg (NO3)två hexahydrat: 88,9 ºC
Kokpunkt
-Mg (NO3)två hexahydrat: kokar inte, sönderdelas vid 330 ºC
Densitet
-Mg (NO3)två vattenfri: 2,32 g / cm3
-Mg (NO3)två dihydrat: 1,456 g / cm3
-Mg (NO3)två hexahydrat: 1464 g / cm3
Löslighet
Vattenfritt magnesiumnitrat är mycket lösligt i vatten: 62,1 g / 100 ml vid 0 ° C; 69,5 g / 100 ml vid 20 ° C Det är också mycket hygroskopiskt, eftersom det är i kontakt med luft snabbt bildar hexahydrat.
Mg (NO3)två dihydrat är också mycket lösligt i vatten och etanol. Det är hygroskopiskt.
Mg (NO3)två hexahydrat är också mycket lösligt i vatten. Det är måttligt lösligt i etanol. Det är den mest stabila av de tre som är i kontakt med luft, det vill säga av de tre som absorberar minst vatten från miljön.
Uppvärmningseffekt
Genom att utsätta en vattenlösning av Mg (NO3)två Vid avdunstning av vatten är saltet som kristalliserar hexahydrat: Mg (NO3)två•6HtvåO. Hexahydrat betyder att i det fasta ämnet varje molekyl Mg (NO3)två är bunden till 6 vattenmolekyler.
Det finns också dihydratet Mg (NO3)två•2HtvåEller, där Mg (NO3)två fast ämne binds till 2 vattenmolekyler.
Uppvärmning av Mg hexahydrat (NO3)två•6HtvåEller det vattenfria saltet erhålls inte, eftersom magnesiumnitrat har hög affinitet för vatten.
Av denna anledning bildar den initialt ett blandat salt av magnesiumnitrat och hydroxid Mg (NO3)två•4 mg (OH)två.
När detta blandade salt når 400 ºC, sönderdelas det till magnesiumoxid MgO och kväveoxidgas frigörs..
Erhållande
Den kan framställas genom att reagera magnesiumkarbonat MgCO3 med salpetersyra HNO3, avger koldioxid COtvå:
MgCO3 + 2 HNO3 → Mg (NEJ3)två + COtvå↑ + HtvåELLER
Det kan också erhållas med magnesiumhydroxid Mg (OH)två och salpetersyra:
Mg (OH)två + 2 HNO3 → Mg (NO3)två + 2 timmartvåELLER
Kommersiellt erhålls det på flera sätt:
1- Reaktion av magnesiummetallen Mg med salpetersyra HNO3.
2- Genom att reagera magnesiumoxid MgO med salpetersyra HNO3.
3- Bindande magnesiumhydroxid Mg (OH)två och ammoniumnitrat NH4INTE3, bilda magnesiumnitrat med utvecklingen av ammoniak NH3.
Plats i naturen
Mg (NO3)två hexahydrat förekommer naturligt i gruvor och grottor eller grottor i form av mineralet nitromagnesit.
Detta mineral finns när guano kommer i kontakt med magnesiumrika bergarter. Guano är materialet som härrör från avföring av sjöfåglar och sälar i mycket torra miljöer..
Applikationer
Mg (NO3)två hexahydrat används i keramik-, kemi- och jordbruksindustrin.
Denna förening är ett gödningsmedel eftersom den ger kväve (N), som är ett av de tre grundläggande element som krävs av växter, och magnesium (Mg), som är en sekundär komponent som också är viktig för växter..
På detta sätt används den med andra ingredienser i växthus och i hydroponisk odling. Den senare består av att odla växterna i en vattenlösning med gödningssalter istället för jord.

Det används också som en katalysator vid erhållande av petrokemiska föreningar. Det gör det möjligt att justera viskositeten i vissa processer. Vattenfritt magnesiumnitrat används i pyroteknik, det vill säga för tillverkning av fyrverkerier.

Vattenfritt magnesiumnitrat är ett uttorkningsmedel. Den används till exempel för att erhålla koncentrerad salpetersyra, eftersom den eliminerar vatten och koncentrerar syraångor upp till 90-95% HNO3.

Det används också för att belägga ammoniumnitrat och möjliggöra bildandet av pärlor av detta komprimerade material..
Det är användbart vid beredning av bläck, toner (svart pulver som används i kopieringssystem) och färgprodukter. Fungerar som en magnesiumstandard inom analytisk kemi.
Saltet av magnesiumnitrat och cerium Mg (NO3)två•Rynka pannan3)3 Det är av intresse för fysikförsök vid låga temperaturer, eftersom det används som kylvätska i adiabatiska demagnetiseringsexperiment (utan värmeöverföring).
Detta magnesium- och ceriumsalt har använts för att fastställa extremt låga temperaturnivåer på Kelvin-skalan (nära absolut noll)..
I de senaste studierna
Flera forskare har använt Mg (NO3)två i kompositioner med syntetiska och naturliga polymerer för att öka konduktiviteten i magnesiumjonbatterier.
Det har också undersökts i konstruktionen av superkondensatorer för lagring av högeffektiv energi.
I sjukdomsstudier
Magnesiumnitrat har administrerats till laboratorieråttor med arteriell hypertoni (högt tryck) och har visat sig effektivt sänka blodtrycket och dämpa eller mildra effekterna av komplikationer av denna sjukdom.
Det har också visat skyddande effekter mot neurologiska störningar (neuronal störning) och mot död hos råttor under halsproppsproggningsprocesser..
Referenser
- Qian, M. et al. (2018). Extraordinära porösa fåskiktskol med hög kapacitans från Pechini-förbränning av magnesiumnitratgel. ACS Appl Mater-gränssnitt 2018, 10 (1): 381-388. Återställd från ncbi.nlm.nih.gov.
- Manjuladevi, R. et al. (2018). En studie om blandad polymerelektrolyt baserad på poly (vynilalkohol) -poly (akrylnitril) med magnesiumnitrat för magnesiumbatteri. Ionics (2018) 24: 3493. Återställd från link.springer.com.
- Kiruthika, S. et al. (2019). Miljövänlig biopolymerelektrolyt, pektin med magnesiumnitratsalt, för applicering i elektrokemiska anordningar. J Solid State Electrochem (2019) 23: 2181. Återställd från link.springer.com.
- Vilskerts R. et al. (2014). Magnesiumnitrat dämpar blodtrycksökningen hos SHR-råttor. Magnes Res 2014, 27 (1): 16-24. Återställd från ncbi.nlm.nih.gov.
- Kuzenkov V.S. och Krushinskii A.L. (2014). Skyddseffekt av magnesiumnitrat mot neurologiska störningar som orsakas av cerebral ischemi hos råttor. Bull Exp Biol Med 2014, 157 (6): 721-3. Återställd från ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Grupp 15 (N, P, As, Sb och Bi) Alkaliska jordföreningar. Magnesiumnitrat. I Encyclopedia of the Alkaline Earth Compounds. Återställd från sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volym 1. Fjärde upplagan. John Wiley & Sons.
- USA National Library of Medicine. (2019). Magnesiumnitrat. Återställd från: pubchem.ncbi.nlm.nih.gov.


Ingen har kommenterat den här artikeln än.