
Nitrobensen (C6H5NO2) struktur, egenskaper, användningsområden, risker
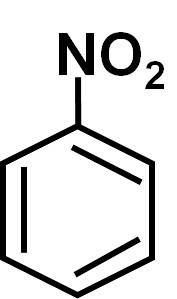
De nitrobensen är en aromatisk organisk förening bildad av en bensenring C6H5- och en nitro-NO-grupptvå. Dess kemiska formel är C6H5INTEtvå. Det är en färglös eller blekgul oljig vätska, som luktar bittera mandlar eller skokräm..
Nitrobensen är en mycket användbar förening inom kemisk industri eftersom det gör det möjligt att erhålla en serie kemiska ämnen som har olika användningsområden. Detta beror på att det kan utsättas för olika typer av reaktioner.
Viktiga kemiska reaktioner inkluderar nitrering (vilket gör att fler -NO-grupper kan tillsättastvå till molekylen) och reduktion (motsatsen till oxidation eftersom de två syreatomerna i nitro-NO-gruppen eliminerastvå och ersätts med väten).
Med nitrobensen kan exempelvis anilin och para-acetaminofenol framställas. Den senare är den välkända acetaminophen som är ett febernedsättande medel (medicin mot feber) och mild smärtstillande medel (medicin mot mindre smärta)..
Nitrobensen bör hanteras med försiktighet eftersom det är irriterande och giftigt, det kan orsaka en typ av anemi, bland flera symtom, och det antas orsaka cancer. Det är också skadligt för miljön.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Flampunkt
- 3.6 Självantändningstemperatur
- 3.7 Densitet
- 3.8 Löslighet
- 3.9 Kemiska egenskaper
- 3.10 Dimerbildning
- 3.11 Övriga egenskaper
- 4 Skaffa
- 5 användningsområden
- 5.1 Vid erhållande av anilin och paracetamol
- 5.2 Vid erhållande av andra kemiska föreningar
- 5.3 I olika applikationer
- 6 risker
- 7 Behandlingar för att eliminera den från miljön
- 8 Referenser
Strukturera
Nitrobensen C6H5-INTEtvå är en platt molekyl bildad av en bensenring C6H5- till vilken en nitro-NO-grupp är bundentvå. Molekylen är platt eftersom det finns en elektronisk interaktion mellan nitro-NO-gruppentvå och bensenringen.
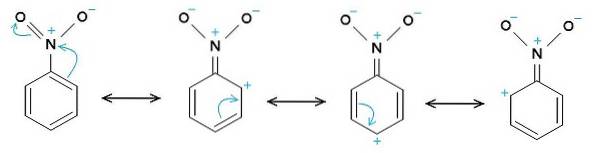
Nitro-NO-gruppentvå tenderar att attrahera elektroner från bensenringen C6H5-.
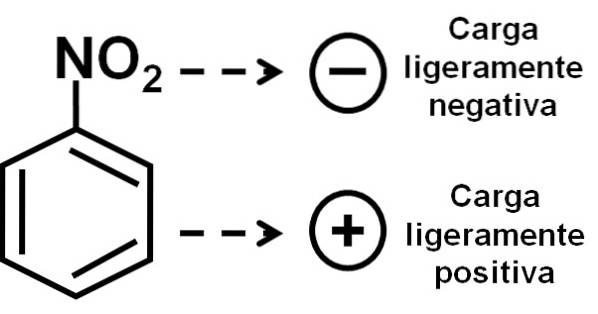
Därför har molekylen en något mer negativ sida (där oxygener av -NOtvå) och en något mer positiv sida (bensenringen).
Nomenklatur
- Nitrobensen.
- Nitrobensin.
- Nitrobensol.
- Myrban eller myrbanolja eller essens (begagnad term).
Egenskaper
Fysiskt tillstånd
Färglös till ljusgul oljig vätska.
Molekylvikt
123,11 g / mol.
Smältpunkt
5,7 ºC.
Kokpunkt
211 ºC.
Flampunkt
88 ºC (sluten koppmetod).
Självantändningstemperatur
480 ° C.
Densitet
1,2037 g / cm3 vid 20 ºC.
Löslighet
Lätt löslig i vatten: 0,19 g / 100 g vatten vid 20 ° C. Helt blandbart med alkohol, bensen och dietyleter.
Kemiska egenskaper
Nitrobensen är stabil upp till cirka 450 ° C vid vilken den börjar sönderfalla (i syrebrist) NO, NOtvå, bensen, bifenyl, anilin, dibensofuran och naftalen.
Viktiga nitrobensenreaktioner inkluderar reduktion, nitrering, halogenering och sulfonering..
Nitrering av nitrobensen producerar initialt metanitrobensen och med en förlängd reaktionstid erhålls 1,3,5-nitrobensen.
Genom att reagera brom eller klor med nitrobensen i närvaro av en lämplig katalysator erhålls 3-brom-nitrobensen (meta-bromnitrobensen) eller 3-klor-nitrobensen (metakloronitrobensen)..
Ett exempel på reduktion är att när man behandlar med tenn (Sn) i saltsyra (HCl), erhålles meta-halogennitrobensenerna meta-halogenanilinerna.
Nitrobensen-sulfonering utförs med rökande svavelsyra vid 70-80 ° C och produkten är metanitrobensensulfonsyra. Detta kan reduceras med järn och HCl för att ge metanilinsyra..
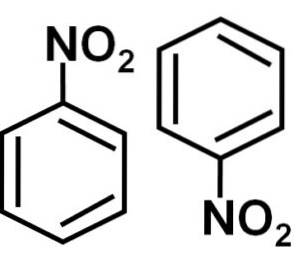
Dimerbildning
I en lösning av bensen C6H6 nitrobensenmolekyler associeras med varandra för att bilda dimerer eller par av molekyler. I dessa par är en av molekylerna i en inverterad position i förhållande till den andra..
Bildningen av nitrobensen-dimerer med molekyler en i en omvänd position i förhållande till den andra beror möjligen på att var och en av dem har en något mer positivt laddad sida och en motsatt sida med en något mer negativ laddning..
I dimeren är sidan med en något mer positiv laddning av en av molekylerna möjligen belägen nära den något negativa laddningen för den andra molekylen, eftersom motsatta laddningar lockar varandra, och detta är fallet med de andra två sidorna..
Andra egenskaper
Har en lukt som mandlar eller skokräm. När den sänker temperaturen stelnar den i form av gröngula kristaller.
Erhållande
Erhålls genom behandling av bensen C6H6 med en blandning av salpetersyra HNO3 och svavelsyra HtvåSW4. Processen kallas nitrering och involverar bildandet av nitroniumjonen NOtvå+ tack vare närvaron av svavelsyra HtvåSW4.
- Nitroniumjon NO-bildningtvå+:
HNO3 + 2 timmartvåSW4 ⇔ H3ELLER+ + 2 HSO4- + INTEtvå+ (nitroniumjon)
- Nitroniumjon attackerar bensen:
C6H6 + INTEtvå+ → C6H6INTEtvå+
- Nitrobensen bildas:
C6H6INTEtvå+ + HSO4- → C6H5INTEtvå + HtvåSW4
Sammanfattningsvis:
C6H6 + HNO3 → C6H5INTEtvå + HtvåELLER
Nitreringsreaktionen av bensen är mycket exoterm, det vill säga mycket värme genereras, så det är mycket farligt.
Applikationer
Vid erhållande av anilin och paracetamol
Nitrobensen används huvudsakligen för att syntetisera anilin C6H5NHtvå, som är en förening som ofta används för framställning av bekämpningsmedel, tandkött, färgämnen, sprängämnen och läkemedel.
Att erhålla anilin sker genom att reducera nitrobensen i ett surt medium i närvaro av järn eller tenn, vilket utförs enligt följande steg:
Nitrobensen → Nitrosobensen → Fenylhydroxylamin → Anilin
C6H5INTEtvå → C6H5NO → C6H5NHOH → C6H5NHtvå

Beroende på förhållandena kan processen stoppas i ett av de mellanliggande stegen, till exempel fenylhydroxylamin. Med utgångspunkt från fenylhydroxylamin i ett starkt surt medium kan para-aminofenol framställas:
Fenylhydroxylamin → sid-Aminofenol
C6H5NHOH → HOC6H4NHtvå
Den senare behandlas med ättiksyraanhydrid för att erhålla paracetamol (acetaminophen), ett känt febernedsättande och milt smärtstillande medel, det vill säga ett läkemedel för behandling av feber och smärta..
Ett annat sätt att erhålla anilin är genom att reducera nitrobensen med kolmonoxid (CO) i ett vattenhaltigt medium i närvaro av mycket små partiklar (nanopartiklar) av palladium (Pd) som en katalysator..
C6H5-INTEtvå + 3 CO + HtvåO → C6H5-NHtvå + 3 COtvå
Vid erhållande av andra kemiska föreningar
Nitrobensen är utgångspunkten för att få ett stort antal föreningar som används som färgämnen, bekämpningsmedel, läkemedel och kosmetika.

Till exempel gör det det möjligt att erhålla 1,3-dinitrobensen, som genom klorering (tillsats av klor) och reduktion (eliminering av syreatomer) genererar 3-kloranilin. Detta används som mellanprodukt för bekämpningsmedel, färgämnen och läkemedel.
Nitrobensen användes för att framställa bensidin som är ett färgämne. Dessutom används nitrobensen för att framställa kinolin, azobensen, metanilsyra, dinitrobensen, isocyanater eller pyroxylin bland många andra föreningar..
I olika applikationer
Nitrobensen används eller har använts som:
- Extraktionslösningsmedel för rening av smörjoljor som används i maskiner
- Lösningsmedel för cellulosaetrar
- Metall polering mix ingrediens
- I tvålar
- I skopoleringsblandningar
- Sprayfärgskonserveringsmedel
- Komponent i golvpoleringsblandningar
- Mandel essensersättning
- I parfymindustrin
- Vid tillverkning av syntetiskt gummi
- Lösningsmedel i olika processer

Risker
Nitrobensen är giftigt vid inandning, intag och absorption genom huden..
Irriterar huden, ögonen och andningsorganen. Det kan orsaka en typ av anemi som kallas metemoglobinemi, vilket innebär en minskning av förmågan hos röda blodkroppar att släppa ut syre i vävnaderna och leder till trötthet..
Dessutom orsakar nitrobensen dyspné, yrsel, nedsatt syn, andfåddhet, kollaps och död. Det skadar också levern, mjälten, njurarna och centrala nervsystemet.
Det uppskattas att det kan vara ett mutagen och möjligen orsaka cancer hos människor, eftersom det har orsakat det hos djur.
Dessutom ska nitrobensen inte kasseras i miljön. Dess toxicitet mot djur, växter och mikroorganismer gör den mycket skadlig för ekosystemen.
Toxicitet mot mikroorganismer minskar deras biologiska nedbrytbarhet.
Behandlingar för att eliminera den från miljön
Miljöförorening med nitrobensen kan uppstå genom avfall från olika industrier som använder det, såsom färg- eller sprängämnesindustrin..
Nitrobensen är en mycket giftig förorening och svår att sönderdelas under naturliga förhållanden, av den anledningen kan den orsaka allvarlig förorening av dricksvatten och bevattningssystem för grödor..
På grund av sin höga stabilitet och toxicitet mot mikroorganismer väljs det ofta som modell i avloppsreningsstudier..
Olika sätt att avlägsna nitrobensen från förorenat vatten undersöks. En av dem är genom fotokatalytisk nedbrytning, det vill säga att använda solljus som en accelerator för nedbrytningsreaktionen i närvaro av titandioxid TiOtvå.

Mikroelektrolysmetoder med en järn (Fe) och koppar (Cu) katalysator i keramik har också testats med framgång. Mikroelektrolys gör att nitrobensen kan brytas ned av en elektrisk ström.
Referenser
- USA National Library of Medicine. (2019). Nitrobensen. Återställd från pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. och Boyd, R.N. (2002). Organisk kemi. 6: e upplagan. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pyrolys av andra kväveinnehållande föreningar. In Pyrolysis of Organic Molecules (andra upplagan). Återställd från sciencedirect.com.
- Smith, P.W.G. et al. (1969). Aromatiska nitrerings-nitroföreningar. Elektrofila substitutioner. I aromatisk kemi. Återställd från sciencedirect.com.
- Windholz, M. et al. (redaktörer) (1983). Merck Index. En encyklopedi av kemikalier, läkemedel och biologiska ämnen. Tionde upplagan. Merck & CO., Inc..
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). UV-bestrålad fotokatalytisk nedbrytning av nitrobensen genom titanbindning på kvartsrör. International Journal of Photoenergy, Volym 2012, artikel-ID 681941. Återställd från hindawi.com.
- Shikata, T. et al. (2014). Anti-parallell dimerbildning av nitrobensen i icke-polära lösningsmedel. AIP Advances 4, 067130 (2014). Återställd från doaj.org.
- Krogul-Sobczak, A. et al. (2019). Reduktion av nitrobensen till anilin med CO / HtvåO i närvaron av Palladium-nanopartiklar. Katalysatorer 2019, 9, 404. Återställd från mdpi.com.
- Yang, B. et al. (2019). Pilot-skala produktion, egenskaper och tillämpning av Fe / Cu katalytisk-keramiskt fyllmedel för nitrobensenföreningar Avloppsvattenrening. Katalysatorer 2019, 9, 11. Återställd från mdpi.com.



Ingen har kommenterat den här artikeln än.