
Polaritet (kemi) polära molekyler och exempel
De kemisk polaritet det är en egenskap som kännetecknas av närvaron av en markant heterogen fördelning av elektrontätheter i en molekyl. I dess struktur finns det därför negativt laddade regioner (δ-), och andra positivt laddade (δ +), vilket genererar ett dipolmoment.
Bindningsdipolmomentet (µ) är ett sätt att uttrycka polariteten hos en molekyl. Det representeras vanligtvis som en vektor vars ursprung är i laddningen (+) och dess ände ligger i laddningen (-), även om vissa kemister representerar den omvänt.
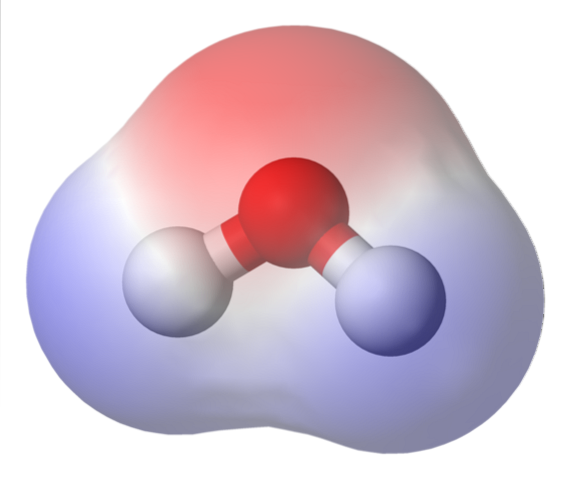
Den översta bilden visar den elektrostatiska potentialkartan för vatten, HtvåO. Den rödaktiga regionen (syreatomen) motsvarar den med den högsta elektrontätheten, och det kan också ses att den sticker ut över de blå regionerna (väteatomer).
Eftersom fördelningen av denna elektrontäthet är heterogen, sägs det att det finns en positiv och en negativ pol. Det är därför man talar om kemisk 'polaritet' och dipolmoment.
Artikelindex
- 1 Dipolmoment
- 1.1 Asymmetri i vattenmolekylen
- 2 polära molekyler
- 3 Exempel
- 3.1 SO2
- 3,2 CHCI3
- 3,3 HF
- 3.4 NH3
- 3.5 Makromolekyler med heteroatomer
- 4 Referenser
Dipole ögonblick
Dipolmomentet µ definieras av följande ekvation:
^ = 6d
Där δ är den elektriska laddningen för varje pol, positiv (+ δ) eller negativ (-δ) och d är avståndet mellan dem.
Dipolmomentet uttrycks vanligtvis i deby, representerat av symbolen D. En coulomb · mätare är lika med 2.998 · 1029 D.
Värdet av dipolmomentet för bindningen mellan två olika atomer är i förhållande till skillnaden i elektronegativiteter för de atomer som bildar bindningen..
För att en molekyl ska vara polär räcker det inte med polära bindningar i sin struktur, men den måste också ha en asymmetrisk geometri; på ett sådant sätt att det förhindrar dipolmomenten att eliminera varandras vektorer.
Asymmetri i vattenmolekylen
Vattenmolekylen har två O-H-bindningar. Molekylens geometri är vinklad, det vill säga i form av ett "V"; så dipolmomenten för bindningarna upphäver inte varandra utan snarare produceras summan av dem som pekar mot syreatomen.
Den elektrostatiska potentialkartan för HtvåEller spegla detta.
Om vinkelmolekylen H-O-H observeras kan följande fråga uppstå: är den verkligen asymmetrisk? Om en imaginär axel dras genom syreatomen kommer molekylen att delas i två lika stora halvor: H-O | O-H.
Men det är inte så om den imaginära axeln är horisontell. När denna axel nu delar upp molekylen igen i två halvor kommer vi att ha syreatomen på ena sidan och de två väteatomerna på den andra..
Av denna anledning den uppenbara symmetrin av HtvåEller så upphör den att existera och anses därför vara en asymmetrisk molekyl.
Polära molekyler
Polära molekyler måste uppfylla en rad egenskaper, såsom:
-Fördelningen av elektriska laddningar i molekylstrukturen är asymmetrisk.
-De är vanligtvis lösliga i vatten. Detta beror på att polära molekyler kan interagera med dipol-dipolkrafter, där vatten kännetecknas av att ha ett stort dipolmoment.
Dessutom är dess dielektriska konstant mycket hög (78,5), vilket gör att den kan hålla de elektriska laddningarna åtskilda, vilket ökar dess löslighet..
-I allmänhet har polära molekyler höga kokpunkter och smältpunkter.
Dessa krafter utgörs av dipol-dipol-interaktionen, Londons dispersiva krafter och bildandet av vätebindningar..
-På grund av sin elektriska laddning kan polära molekyler leda elektricitet.
Exempel
SWtvå
Svaveldioxid (SOtvå). Syre har en elektronegativitet på 3,44, medan svavelens elektronegativitet är 2,58. Därför är syre mer elektronegativt än svavel. Det finns två S = O-bindningar, O har en δ-laddning och S en δ-laddning+.
Eftersom det är en vinkelmolekyl med S vid toppunkten är de två dipolmomenten orienterade i samma riktning; och därför läggs de samman och gör SO-molekylentvå vara polär.
CHCl3
Kloroform (HCCl3). Det finns en C-H-bindning och tre C-Cl-bindningar.
Elektronegativiteten för C är 2,55 och elektronegativiteten för H är 2,2. Således är kol mer elektronegativt än väte; och därför kommer dipolmomentet att orienteras från H (δ +) mot C (δ-): C5--H5+.
När det gäller C-Cl-bindningar har C en elektronegativitet på 2,55, medan Cl har en elektronegativitet på 3,16. Dipolvektorn eller dipolmomentet orienteras från C mot Cl i de tre C-bindningarna 5+-Cl 5-.
Eftersom det finns en elektronfattig region, runt väteatomen, och en elektronrik region som består av de tre kloratomerna, CHCl3 anses vara en polär molekyl.
HF
Vätefluorid har bara en H-F-bindning. Elektronegativiteten för H är 2.22 och elektronegativiteten för F är 3.98. Därför hamnar fluor med den högsta elektrontätheten, och bindningen mellan båda atomerna beskrivs bäst som: H5+-F5-.
NH3
Ammoniak (NH3) har tre N-H-obligationer. Elektronegativiteten för N är 3.06 och elektronegativiteten för H är 2.22. I alla tre bindningarna är elektrontätheten orienterad mot kväve, eftersom den är ännu högre på grund av närvaron av ett par fria elektroner.
NH-molekylen3 det är tetrahedral, med N-atomen som upptar toppunkten. De tre dipolmomenten, som motsvarar N-H-bindningarna, är orienterade i samma riktning. I dem är δ- belägen i N och δ + i H. Således är bindningarna: N5--H5+.
Dessa dipolmoment, molekylens asymmetri och det fria elektronparet på kväve gör ammoniak till en mycket polär molekyl..
Makromolekyler med heteroatomer
När molekylerna är mycket stora är det inte längre säkert att klassificera dem som apolära eller polära själva. Detta beror på att det kan finnas delar av dess struktur med både apolära (hydrofoba) och polära (hydrofila) egenskaper..
Dessa typer av föreningar är kända som amfifiler eller amfipatika. Eftersom den apolära delen kan betraktas som elektronfattig med avseende på den polära delen, finns det en polaritet närvarande i strukturen och amfifila föreningar anses vara polära föreningar..
En makromolekyl med heteroatomer kan i allmänhet förväntas ha dipolmoment och därmed kemisk polaritet..
Heteroatomer förstås vara de som skiljer sig från de som utgör strukturens skelett. Till exempel är kolskelettet biologiskt det viktigaste av allt, och atomen med vilken kol bildar en bindning (förutom väte) kallas heteroatom..
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Prof. Krishnan. (2007). Polära och icke-polära föreningar. St. Louis Community College. Återställd från: users.stlcc.edu
- Murmson, Serm. (14 mars 2018). Hur man förklarar polaritet. Sciencing. Återställd från: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (5 december 2018). Polar Bond Definition och exempel (Polar Covalent Bond). Återställd från: thoughtco.com
- Wikipedia. (2019). Kemisk polaritet. Återställd från: en.wikipedia.org
- Quimitube. (2012). Kovalent bindning: bindningspolaritet och molekylär polaritet. Återställd från: quimitube.com



Ingen har kommenterat den här artikeln än.