
Vad är förångning?

De förångning är processen att omvandla en kemisk substans från ett flytande eller fast tillstånd till ett gasformigt eller ångformigt tillstånd. Andra termer som används för att beskriva samma process är förångning, destillation och sublimering..
Ett ämne kan ofta separeras från ett annat genom förångning och kan sedan återvinnas genom ångkondensation..

Ämnet kan snabbare förångas genom att antingen värma det för att öka dess ångtryck eller genom att avlägsna ångan med en inert gasström eller en vakuumpump..
Uppvärmningsprocedurer inkluderar förångning av vatten, kvicksilver eller arseniktriklorid för att separera dessa ämnen från störande element..
Kemiska reaktioner används ibland för att producera flyktiga produkter som vid utsläpp av koldioxid från karbonater, ammoniak i Kjeldahlmetoden för bestämning av kväve och svaveldioxid vid bestämning av svavel i stål.
Förångningsmetoderna kännetecknas i allmänhet av stor enkelhet och enkel användning, förutom när höga temperaturer eller material som är mycket motståndskraftiga mot korrosion behövs (Louis Gordon, 2014).
Förångning av ångtryck
Vet du att vattentemperaturen är 100 ° C, har du någonsin undrat varför regnvatten avdunstar??
Är det 100 ° C? Om så är fallet, varför blir jag inte varm? Har du någonsin undrat vad som ger den karakteristiska aromen till alkohol, vinäger, trä eller plast? (Ångtryck, S.F.)
Ansvarig för allt detta är en egenskap som kallas ångtryck, vilket är trycket som utövas av en ånga i jämvikt med den fasta eller flytande fasen i samma substans..
Ämnets partiella tryck i atmosfären på fastämnet eller vätskan (Anne Marie Helmenstine, 2014).
Ångtryck är ett mått på materialets tendens att förändras till gas- eller ångtillstånd, det vill säga ett mått på ämnens flyktighet.
När ångtrycket ökar, desto större är kapaciteten hos vätskan eller det fasta ämnet att avdunsta, vilket blir mer flyktigt..
Ångtrycket ökar med temperaturen. Temperaturen vid vilken ångtrycket på en vätskes yta är lika med trycket som utövas av miljön kallas vätskans kokpunkt (Encyclopædia Britannica, 2017).
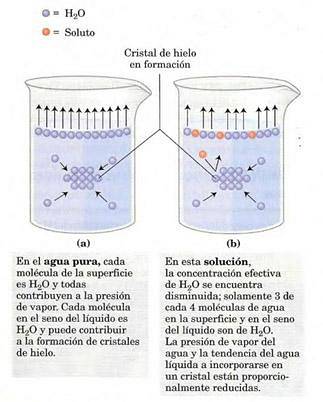
Ångtrycket beror på det lösta ämnet löst i lösning (det är en kolligativ egenskap). På ytan av lösningen (luft-gas-gränssnitt) tenderar de mest ytliga molekylerna att avdunsta, utbyta mellan faser och generera ett ångtryck..
Närvaron av löst ämne minskar antalet lösningsmedelsmolekyler vid gränsytan, vilket minskar ångtrycket..
Förändringen i ångtryck kan beräknas med Raoults lag för icke-flyktiga lösta ämnen som ges av:
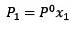
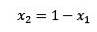
Där X2 är molfraktionen av lösningsmedlet. Om vi multiplicerar båda sidor av ekvationen med P ° förblir den:
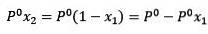
Att ersätta (1) i (3) är:
(4)
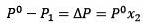
Detta är variationen i ångtryck när ett löst ämne löser sig (Jim Clark, 2017).
Gravimetrisk analys
Gravimetrisk analys är en klass av laboratorietekniker som används för att bestämma massan eller koncentrationen av ett ämne genom att mäta en förändring i massan..
Kemikalien vi försöker kvantifiera kallas ibland analyten. Vi kan använda gravimetrisk analys för att svara på frågor som:
- Vad är koncentrationen av analyten i en lösning?
- Hur rent är vårt prov? Provet här kan vara en fast eller i lösning.
Det finns två vanliga typer av gravimetrisk analys. Båda handlar om att ändra analysfasen för att separera den från resten av en blandning, vilket leder till en förändring av massan..
En av dessa metoder är utfällningsgravimetri, men den vi verkligen är intresserad av är förångningsgravimetri.
Volatilisering gravimetri är baserad på att termiskt eller kemiskt sönderdela provet och mäta den resulterande förändringen i dess massa..
Alternativt kan vi fånga och väga en flyktig nedbrytningsprodukt. Eftersom frisättningen av en flyktig art är en väsentlig del av dessa metoder klassificerar vi dem kollektivt som gravimetriska analysmetoder för förångning (Harvey, 2016).
Gravimetriska analysproblem är helt enkelt stökiometriproblem med några extra steg.
För att utföra någon stökiometrisk beräkning behöver vi koefficienterna för den balanserade kemiska ekvationen.
Till exempel om ett prov innehåller bariumkloriddihydrat (BaCltvå● HtvåO), kan mängden föroreningar erhållas genom att värma upp provet för att avdunsta vattnet.
Skillnaden i massa mellan det ursprungliga provet och det uppvärmda provet ger oss, i gram, mängden vatten i bariumkloriden.
Med en enkel stökiometrisk beräkning kommer mängden föroreningar i provet att erhållas (Khan, 2009).
Fraktionerad destillation
Fraktionerad destillation är en process genom vilken komponenterna i en flytande blandning separeras i olika delar (kallade fraktioner) beroende på deras olika kokpunkter..
Skillnaden i flyktighet hos föreningarna i blandningen spelar en grundläggande roll i deras separation..
Fraktionerad destillation används för att rena kemikalier och också för att separera blandningar för att erhålla deras komponenter. Det används som laboratorieteknik och inom industrin, där processen har stor kommersiell betydelse.
Ångor från en kokande lösning passerar genom en hög kolonn, kallad en fraktioneringskolonn..
Kolonnen är packad med plast- eller glaspärlor för att förbättra separationen genom att ge mer ytarea för kondens och avdunstning.
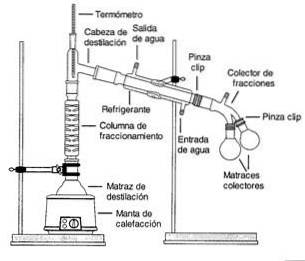
Kolonnens temperatur minskar gradvis längs dess längd. Komponenter med en högre kokpunkt kondenseras i kolonnen och återgår till lösning.
Komponenter med lägre kokpunkter (mer flyktiga) passerar genom kolonnen och samlas nära toppen.
Teoretiskt förbättrar separationen med fler pärlor eller plattor, men att lägga till plattor ökar också den tid och energi som krävs för att slutföra en destillation (Helmenstine, 2016)..
Referenser
- Anne Marie Helmenstine. (2014, 16 maj). Definition av ångtryck. Återställd från thoughtco.com.
- Encyclopædia Britannica. (2017, 10 februari). Ångtryck. Återställd från britannica.com.
- Harvey, D. (2016, 25 mars). Volatilization Gravimetry. Återställd från kem.libretexts.
- Helmenstine, A. M. (2016, 8 november). Delad destillationsdefinition och exempel. Återställd från thoughtco.com.
- Jim Clark, I. L. (2017, 3 mars). Raoults lag. Återställd från kem.libretexts.
- Khan, S. (2009, 27 augusti). Introduktion till gravimetrisk analys: Volatilization gravimetry. Återställd från khanacademy.
- Louis Gordon, R. W. (2014). Återställd från accessscience.com.
- Ångtryck. (S.F.). Återställd från chem.purdue.edu.
Ingen har kommenterat den här artikeln än.