
Colligativa egenskaper (med formler)
De kolligativ egendom är någon egenskap hos ett ämne som beror på, eller varierar beroende på, antalet partiklar som finns i det (i form av molekyler eller atomer), utan att bero på partiklarnas natur.
Med andra ord kan dessa också förklaras som egenskaper hos lösningar som beror på förhållandet mellan antalet lösta partiklar och antalet lösningsmedelspartiklar. Detta koncept introducerades 1891 av den tyska kemisten Wilhelm Ostwald, som klassificerade lösningsmedlets egenskaper i tre kategorier.

Dessa kategorier förkunnade att kolligativa egenskaper enbart berodde på koncentrat och temperatur av löst ämne och inte på dess partiklar..
Dessutom berodde tillsatsegenskaper såsom massa på sammansättningen av det upplösta ämnet och konstitutionella egenskaper berodde mer på den upplösta molekylens struktur..
Artikelindex
- 1 Kolligativa egenskaper
- 1.1 Minskning av ångtryck
- 1.2 Höja koktemperaturen
- 1.3 Sänka frystemperaturen
- 1.4 Osmotiskt tryck
- 2 Referenser
Kolligativa egenskaper
De kolligativa egenskaperna studeras främst för utspädda lösningar (på grund av deras nästan idealiska beteende) och är som följer:
Minskning av ångtryck
Det kan sägas att ångtrycket i en vätska är jämviktstrycket i ångmolekylerna som vätskan är i kontakt med.
På samma sätt förklaras förhållandet mellan dessa tryck med Raoults lag, som uttrycker att en komponents partiella tryck är lika med produkten av komponenten molfraktion av komponentens ångtryck i dess rena tillstånd:
PTILL = XTILL . PºTILL
I detta uttryck:
PTILL = Partiellt ångtryck av komponent A i blandningen.
XTILL = Molfraktion av komponent A.
PºTILL= Ångtryck av ren komponent A.
I fallet med minskning av ångtrycket för ett lösningsmedel inträffar detta när en icke-flyktig löst substans tillsätts till den för att bilda en lösning. Som känt och per definition har en icke-flyktig substans inte en tendens att avdunsta.
Av denna anledning, desto mer av detta lösningsmedel tillsätts till det flyktiga lösningsmedlet, desto lägre kommer ångtrycket att vara och desto mindre kan lösningsmedlet släppa ut och bli ett gasformigt tillstånd..
Så när lösningsmedlet avdunstar naturligt eller med våld kommer en mängd lösningsmedel slutligen att finnas kvar utan att avdunsta tillsammans med det icke-flyktiga lösningsmedlet..
Detta fenomen kan förklaras bättre med begreppet entropi: när molekylerna gör en övergång från vätskefasen till gasfasen ökar entropin i systemet..
Detta innebär att entropin för denna gasfas alltid kommer att vara större än för flytande tillstånd, eftersom gasmolekylerna upptar en större volym..
Sedan, om entropin i det flytande tillståndet ökar genom utspädning, även om den är kopplad till en löst substans, minskar skillnaden mellan de två systemen. Av denna anledning minskar också entropin ångtrycket..
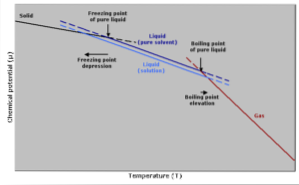
Koktemperaturhöjning
Kokpunkten är den temperatur vid vilken det finns jämvikt mellan vätske- och gasfaserna. Vid denna tidpunkt är antalet gasmolekyler som blir flytande (kondenserande) lika med antalet flytande molekyler som avdunstar till gas..
Tillsatsen av ett löst ämne gör att koncentrationen av flytande molekyler späds ut, vilket gör att avdunstningshastigheten minskar. Detta genererar en förändring av kokpunkten för att kompensera för förändringen i lösningsmedelskoncentrationen..
Med andra enklare ord är koktemperaturen för en lösning högre än för lösningsmedlet i dess rena tillstånd. Detta uttrycks av ett matematiskt uttryck som visas nedan:
ATb = i. Kb . m
I detta uttryck:
ATb = Tb (lösning) - Tb (lösningsmedel) = Variation av koktemperaturen.
i = van't Hoff-faktor.
Kb = Lösningsmedlets kokande konstant (0,512 ºC / molal för vatten).
m = molalitet (mol / kg).
Frysande temperaturreduktion
Frysetemperaturen för ett rent lösningsmedel kommer att minska när en mängd löst ämne tillsätts, eftersom det påverkas av samma fenomen som ångtrycket minskar..
Detta händer för att, genom att sänka lösningsmedlets ångtryck genom att späda ett löst ämne, krävs en lägre temperatur för att få det att frysa..
Frysningsprocessens karaktär kan också beaktas för att förklara detta fenomen: för att en vätska ska frysa måste den nå ett ordnat tillstånd där den slutar bilda kristaller..
Om det finns föroreningar i vätskan i form av lösta ämnen, kommer vätskan att beställas mindre. Av denna anledning kommer lösningen att ha större svårigheter att frysa än ett lösningsmedel utan föroreningar..
Denna minskning uttrycks som:
ATF = -i. KF . m
I ovanstående uttryck:
ATF = TF (lösning) - TF (lösningsmedel) = Frysningstemperaturvariation.
i = van't Hoff-faktor.
KF = Lösningsmedlets frysningskonstant (1,86 ºC kg / mol för vatten).
m = molalitet (mol / kg).
Osmotiskt tryck
Processen känd som osmos är tendensen hos ett lösningsmedel att passera genom ett semipermeabelt membran från en lösning till en annan (eller från ett rent lösningsmedel till en lösning).
Detta membran representerar en barriär genom vilken vissa ämnen kan passera och andra inte, som i fallet med semipermeabla membran i cellväggarna i djur- och växtceller..
Osmotiskt tryck definieras sedan som det minsta tryck som måste appliceras på en lösning för att stoppa passagen av dess rena lösningsmedel genom ett semipermeabelt membran..
Det är också känt som ett mått på tendensen hos en lösning att ta emot det rena lösningsmedlet på grund av effekten av osmos. Denna egenskap är kolligativ eftersom den beror på koncentrationen av löst ämne i lösningen, som uttrycks som ett matematiskt uttryck:
Π. V = n. R. T, eller också π = M. R. T
I dessa uttryck:
n = Antal mol partiklar i lösningen.
R = Universalgaskonstant (8.314472 J. K-1 . mol-1).
T = temperatur i Kelvin.
M = molaritet.
Referenser
- Wikipedia. (s.f.). Colligativa egenskaper. Hämtad från en.wikipedia.org
- FÖRE KRISTUS. (s.f.). Colligativa egenskaper. Återställd från opentextbc.ca
- Bosma, W. B. (s.f.). Colligativa egenskaper. Hämtad från chemistryexplained.com
- Sparknoter. (s.f.). Colligativa egenskaper. Återställd från sparknotes.com
- University, F. S. (s.f.). Colligativa egenskaper. Hämtad från chem.fsu.edu
Ingen har kommenterat den här artikeln än.