
Vad är molalitet? (med exempel)
De molalitet, betecknas med gemener m, det är en term som används för att beskriva koncentrationen av en lösning. Det kan definieras som antalet mol av ett löst ämne upplöst i 1 kg lösningsmedel.
Det är lika med mol upplöst ämne (ämnet som upplöses) dividerat med kilo lösningsmedel (ämnet som används för att lösa sig).
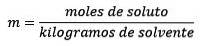
Där mol upplösta ämnen ges av ekvationen:
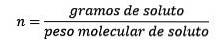
Så i slutändan är molalitetsekvationen

Artikelindex
- 1 Kännetecken för molalitet
- 2 Skillnader och likheter mellan molalitet (m) och molaritet (M)
- 3 Exempel på molalitet
- 3.1 Exempel 1:
- 3.2 Exempel 2:
- 3.3 Exempel 3:
- 4 Referenser
Kännetecken för molalitet
Molalitet är ett mått på koncentrationen av en löst substans i en lösning. Används främst när temperaturen är ett problem.

Molalitet är inte lika vanligt som dess motsvarighet, molaritet (mol löst ämne per liter lösningsmedel), men den används i mycket specifika beräkningar, särskilt med avseende på kolligativa egenskaper (kokpunkt, kokpunkt, nedsättning av kokpunkt)..
Eftersom volymen är föremål för variation på grund av temperatur och tryck varierar molariteten också beroende på temperatur och tryck. I vissa fall är viktförbrukningen en fördel eftersom massan inte varierar med miljöförhållandena..
Det är viktigt att lösningsmedlets massa används och inte lösningens massa. Lösningar märkta med molkoncentration anges med gemener m. En 1,0 m lösning innehåller 1 mol löst ämne per kg lösningsmedel.
Beredningen av en lösning med en given molalitet är enkel eftersom den bara kräver en bra skala. Både lösningsmedel och löst ämne blandas snarare än uppmätt i volym.
SI-enheten (International System) för molalitet är mol / kg, eller mol upplöst per kg lösningsmedel. En lösning med en molalitet av 1 mol / kg beskrivs ofta som "1 molal" eller "1 m".
Enligt SI-enhetssystemet anser National Institute of Standards and Technology, som är den amerikanska myndigheten för mätning, termen "molal" och enhetssymbolen "m" vara föråldrad och föreslår att man använder mol / kg.
Skillnader och likheter mellan molalitet (m) och molaritet (M)
Framställningen av en lösning med en given molalitet innefattar vägning av både lösningsmedlet och lösningsmedlet och erhållande av deras massor..
Men när det gäller molaritet mäts lösningsvolymen, vilket ger utrymme för densitetsvariationer som ett resultat av omgivningens temperatur och tryck..
Detta innebär att det är fördelaktigt att arbeta med molaliteten som hanterar massan eftersom i den kemiska sammansättningen är massan av en känd ren substans viktigare än dess volym eftersom volymerna kan ändras under inverkan av temperatur och tryck medan massan förblir oförändrad.
Vidare sker kemiska reaktioner i proportion till massa, inte volym. För att vara baserad på massa kan molalitet lätt omvandlas till ett massförhållande eller en massfraktion.
För vattenlösningar (lösningar där vatten är lösningsmedlet) nära rumstemperatur är skillnaden mellan molära och molära lösningar försumbar..
Detta beror på att runt rumstemperatur har vatten en densitet på 1 kg / L. Detta betyder att "per L" molaritet är lika med "per kg" molalitet..
För ett lösningsmedel såsom etanol, där densiteten är 0,789 kg / l, skulle en 1 M-lösning vara 0,789 m.
Den viktiga delen av att komma ihåg skillnaden är:
Molaritet - M → mol per liter lösning.
Molalitet - m → mol per kg lösningsmedel.
Exempel på molalitet
Exempel 1:
Problem: Vad är molaliteten hos en lösning innehållande 0,086 mol NaCl upplöst i 25,0 g vatten?
Svar: Detta exempel använder direkt molalitetsekvationen:
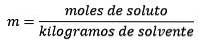
Mol av löst ämne (NaCl) = 0,086 mol
Massa (vatten) = 25,0 g = 25,0 x 10-3 kg
Att ersätta har vi:
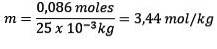
Exempel 2:
Problem: Vad är molaliteten för en lösning om 124,2 gram NaOH löses i 1,00 liter vatten? (Vattentätheten är lika med 1,00 g / ml).
Svar: Vatten kallas det universella lösningsmedlet och densiteten ges vanligtvis som 1,00 gram per milliliter, eller vad är samma som 1 kg per liter. Detta gör det enkelt att omvandla från liter till kilo..
I detta problem måste 124,2 gram NaOH omvandlas till mol (för mol upplöst) och en liter vatten måste omvandlas till kg (per kg lösningsmedel) med användning av densiteten.
Hitta först molmassan av NaOH:
P.M.Na= 22,99 g / mol
P.M.ELLER= 16 g / mol
P.M.H= 1 g / mol
P.M.NaOH= 22,99 g / mol +16 g / mol +1 g / mol = 39,99 g / mol
För det andra omvandlar du gram NaOH till mol med molmassa:
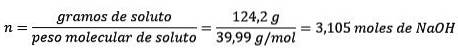
För det tredje, omvandla liter vatten till kilogram med hjälp av densiteten.
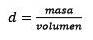
Lösningen för massan återstår
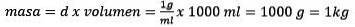
Slutligen löses molalitetsekvationen:
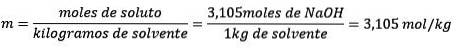
Exempel 3:
Problem: Vad är massan av vatten i en vattenlösning innehållande 0,52 gram bariumklorid (BaCltvå, PM = 208,23 g / mol) vars koncentration är 0,005 mol / kg?
Svar: i detta fall används molalkoncentrationen för att bestämma mängden vatten i lösningen.
Först erhålls antalet mol BaCltvå i lösningen:
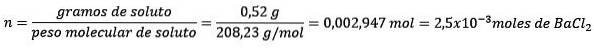
För det andra, ta bort kilogram lösningsmedel från molalitetsekvationen och lös för.
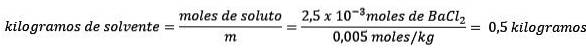
Referenser
- Vetenskapliga anteckningar och projekt. (2015, 22 februari). Beräkning av molalitetsexempel Problem. Återställd från sciencenotes.org.
- Bhardwaj, M. (2014, 26 november). Vad är ett exempel på molalitet? Återställd från socratic.org.
- (S.F.). Molalitet. Återställd från boundless.com.
- Helmenstine, T. (2017, 19 februari). Vad är skillnaden mellan molaritet och molalitet? Återställd från thoughtco.com.
- Molalitetsformel. (S.F.). Återställd från softschools.com.
- Molalitet. (S.F.). Återställd från chemteam.l
- Vad är molalitet?? (S.F.). Återställd från freechemistryonline.com.



Ingen har kommenterat den här artikeln än.